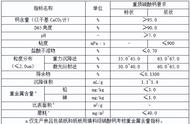
三、基础辨析、填空
1.你知道他们对错的原因吗? (打“√”“×”)
(1)溶液导电能力弱的电解质一定是弱电解质( )
(2)弱电解质浓度越大,电离程度越大( )
(3)温度升高,弱电解质的电离平衡右移( )
(4)0.1 mol/L某一元酸HA溶液的pH=3,HA溶液中存在:HA===H++A-( )
(5)温度不变,向CH3COOH溶液中加入CH3COONa,平衡左移( )
(6)电离平衡常数(K)越小,表示弱电解质电离能力越弱( )
(7)不同浓度的同一弱电解质,其电离平衡常数(K)不同( )
(8)电离平衡右移,电离平衡常数一定增大( )
(1)× (2)× (3)√ (4)× (5)√ (6)√ (7)× (8)×
2.NH3·H2O在水溶液中的电离方程式为:___________,
其电离常数表达式为:___________。
对该电离平衡改变条件如下:①升高温度 ②加水稀释 ③加少量NaOH(s) ④通少量HCl(g) ⑤加入NH4Cl(s),其中:
(1)使电离平衡右移的有________;
(2)使c(OH-)增大的有________;
(3)使电离常数改变的有________。
答案 NH3·H2O⇌NH4 +OH-
K=

(1)①②④ (2)①③ (3)①
四、熟记:
1、两种类别:①强电解质:强酸、强碱、绝大多数盐;②弱电解质:弱酸、弱碱、水。
2、两个特征:v(离解)=v(结合)≠0;分子、离子浓度保持不变。
3、三个影响因素:温度、浓度、相同离子。
4、一个表达式:K=

5、影响电离平衡的因素
(1)内因
弱电解质本身的性质,决定了弱电解质电离平衡强弱。如相同条件下CH3COOH电离程度大于H2CO3。
(2)外因
电离平衡属于动态平衡,当外界条件改变时,弱电解质的电离平衡也会发生移动,平衡移动也遵循勒夏特列原理。
以CH3COOH⇌CH3COO-+H+ ΔH>0为例:

6、特别提醒
(1)电离常数只与温度有关,升温电离常数增大,与酸碱性无关。
(2)溶液的导电性与溶液中离子浓度大小和带的电荷数有关。
典例:室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓
B.加水稀释后,溶液中c(NH4 )·c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
7、从“定性”和“定量”两角度理解电离平衡
(1)从定性角度分析电离平衡:应该深刻地理解勒夏特列原理——平衡向“减弱”这种改变的方向移动,移动结果不能“抵消”或“超越”这种改变。
(2)从定量角度分析电离平衡:当改变影响电离平衡的条件后分析两种微粒浓度之比的变化时,若通过平衡移动的方向不能作出判断时,应采用化学平衡常数定量分析。
典例:在0.1 mol·L-1NH3·H2O溶液中存在如下平衡:NH3+H2O⇌NH3·H2O⇌NH4 +OH-。下列叙述中正确的是( )
A.加入少量浓盐酸,盐酸与NH3反应生成NH4Cl,使NH3浓度减小,NH4 浓度增大,平衡逆向移动
B.加入少量NaOH固体,OH-与NH4 结合生成NH3·H2O,使NH4 浓度减小,平衡正向移动
C.加入少量0.1 mol·L-1 NH4Cl溶液,电离平衡常数不变,溶液中c(OH-)减小
D.加入少量MgSO4固体,溶液pH增大
典例:用水稀释0.1 mol·L-1 CH3COOH时,溶液中随着水量的增加而减小的是( )
A.c(CH3COOH)/c(OH-) B.c(OH-)/c(H+)
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
8、一元强酸(碱)和一元弱酸(碱)的比较
强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质,以盐酸和醋酸为例。