高中化学涉及到的反应是以氧化还原反应为主题,又经常以离子方程式的形式来体现,在高考题中经常涉及到的一些复杂氧化还原反应离子方程式的书写,对于高三学生来讲,很多时候无从下手,似懂非懂,老师一讲就会,自己一写就错。
每次模拟考试几乎都要会涉及到,可每次还是写不对。
究竟有没有一种可行有效的方法解决这个问题呢?笔者通过对众多氧化还原反应的离子方程式书写的体验中找到了一种行之有效的方法,并把这个方法称之为分解法。
分解法的步骤
作为一种方法若要很好地让学掌握,必须有强化的手段。强化理论认为人的行为是对其所获刺激的函数。如果这种刺激对他有利,则这种行为就会重复出现;若对他不利,则这种行为就会减弱直至消失。因此教师要采取各种强化方式,以使学生的行为符合方法掌握所以达到的目标。
下面是强化的原则
1.要依照强化对象的不同采用不同的强化措施。
2.小步子前进,分阶段设立目标,并对目标予以明确规定和表述。
3.及时反馈。
4.消不固定时间和频率间隔的强化效果好。
5.正强化比负强化更有效。
一、如何进行有效地学习
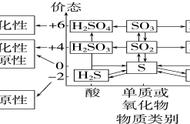
(一)了解必备的知识:必须掌握的元素及其形成的具有强氧化性和强还原性的物质或离子
1.高中新课程教材中所涉及到的元素有:
Na 、Al、Fe、Cu、Si、N、O、S、Cl、Br、I
2.元素形成具有强氧化性和强还原性的物质或离子的归纳:
强氧化性物质或离子:Na2O2、Fe3 、Fe(OH)3 、Fe2O3、Fe3O4、NO、NO2 HNO3(浓)、 HNO3(稀)、O2、O3 、H2O2、H2SO4(浓)、Cl2 、HClO、NaClO、Ca(ClO)2、Br2 、I2、
KMnO4(H )、K2Cr2O7(H )
强还原性物质或离子:Fe2 、FeO、 Fe3O4、Fe(OH)2 、 FeS 、FeS2 、FeBr2、FeI2、CuS、 Cu2S、Cu2O、CuH、SO2、H2SO3 、Na2SO3、NaHSO3、H2S、Na2S、NaHS、Na2S2O3、NaI
3.下表是必须掌握的转化关系
(2) 了解学习金字塔理论
学习金字塔是美国缅因州的国家训练实验室研究成果,它用数字形式形象显示了:采用不同的学习方式,学习者在两周以后还能记住内容(平均学习保持率)的多少。它是一种现代学习方式的理论。最早它是由美国学者、著名的学习专家爱德加·戴尔1946年首先发现并提出的。

在塔尖,第一种学习方式——"听讲",也就是老师在上面说,学生在下面听,这种我们最熟悉最常用的方式,学习效果却是最低的,两周以后学习的内容只能留下5%。
第二种,通过"阅读"方式学到的内容,可以保留10%。
第三种,用"声音、图片"的方式学习,可以达到20%。
第四种,是"示范",采用这种学习方式,可以记住30%。
第五种,"小组讨论",可以记住50%的内容。
第六种,"做中学"或"实际演练",可以达到75%。
最后一种在金字塔基座位置的学习方式,是"教别人"或者"马上应用",可以记住90%的学习内容。
爱德加·戴尔提出,学习效果在30%以下的几种传统方式,都是个人学习或被动学习;而学习效果在50%以上的,都是团队学习、主动学习和参与式学习。
听讲、阅读、运用视听等学习方式,是属于大脑被动接受知识的学习行为,故此知识保留率最低;而实践和教授给他人等主动学习行为,则相对而言会比较高。尤其是主动教授给他人这种行为,知识的留存率高达90%。
根据学习金字塔理论,运用高效地学习方法设计的教学环节如下:
环节一:(教师示范)写出Ca(ClO)2和足量SO2反应的离子方程式:
环节二:(学生模仿)
1.写出碱性条件下Cl2和Na2S2O3反应的离子方程式:4Cl2 S2O32- 10OH—=8Cl- 2SO42- 5H2O。
2.写出碱性条件下NaClO和FeSO4反应的离子方程式:3ClO- 6Fe2 3H2O=2Fe(OH)3↓ 3Cl- 4Fe3 。
3.写出酸性条件下NO2 和FeSO4反应的离子方程式:NO2 2Fe2 2H =NO 2Fe3 H2O。
环节三:(小组讨论)
1.写出HNO3(稀)和 FeSO4反应的离子方程式:NO3- 3Fe2 4H =NO↑ 3Fe3 2H2O。
2.写出酸性条件下KMnO4和FeSO4反应的离子方程式:MnO4- 5Fe2 8H =Mn2 5Fe3 4H2O。
3.写出酸性条件下K2Cr2O7和 FeSO4反应的离子方程式:Cr2O72- 6Fe2 14H =2Cr3 6Fe3 7H2O。
环节四:(实际演练)
1.写出HNO3(稀)和 FeS反应的离子方程式:NO3- FeS 4H =NO↑ Fe3 S 2H2O。
2.写出HNO3(稀)和 Cu2S反应的离子方程式:4NO3- 3Cu2S 16H =4NO↑ 6Cu2 3S 8H2O。
3.写出酸性条件下H2O2和FeSO4反应的离子方程式:H2O2 2Fe2 2H =2H2O 2Fe3 。
(三)了解遗忘曲线
遗忘曲线由德国心理学家艾宾浩斯(H.Ebbinghaus)研究发现,描述了人类大脑对新事物遗忘的规律。人体大脑对新事物遗忘的循序渐进的直观描述,人们可以从遗忘曲线中掌握遗忘规律并加以利用,从而提升自我记忆能力。该曲线对人类记忆认知研究产生了重大影响。
艾宾浩斯(H.Ebbinghaus)的研究发现,遗忘在学习之后立即开始,而且遗忘的进程并不是均匀的。最初遗忘速度很快,以后逐渐缓慢。他认为"保持和遗忘是时间的函数", 并根据他的实验结果绘成描述遗忘进程的曲线,即著名的艾宾浩斯记忆遗忘曲线。

根据艾宾浩斯遗忘曲线的运作,我们的记忆在第二天就开始遗忘学到的知识。如果不及时回顾,之后的时间,就很快就学到的东西全忘记了。
所以,学完之后的第二天,可以专选找个时间,高强度地重温你学过的知识,获得进一步深刻的记忆。
整个流程下来,我们的目的就是让大脑获得大量的信息输入。
这段时间对我们来说,肯定是很痛苦的。之所以痛苦,就是因为我们要试图接收看到的每个信息,然后对此进行思考。
根据遗忘曲线,运用及时巩固最佳时间的方法设计的学习环节如下:
环节一:当天的巩固内容
1.Na2O2一剑封喉——Na2O2与水反应的价值分析
(1)写出Na2O2和FeSO4溶液反应的离子方程式:3Na2O2 6Fe2 6H2O=2Fe3 2Na Fe(OH)3↓;
(2)写出Na2O2和Na2S溶液反应的离子方程式:Na2O2 S2- 2H2O=4OH- 2Na S↓;
(3)写出Na2O2和Na2SO3溶液反应的离子方程式:Na2O2 SO32- H2O=2Na SO42- 2OH-;
(4)写出Na2O2和NaI溶液反应的离子方程式:Na2O2 2I- 2H2O=4OH- 2Na I2;
2.H2O2趁火打劫——H2O2分解反应的价值分析
(1)写出酸性条件下H2O2和FeSO4溶液反应的离子方程式:H2O2 2Fe2 3H =2Fe3 2H2O;
(2)写出酸性条件下H2O2和Na2S溶液反应的离子方程式:H2O2 S2- 2H =S↓ 2H2O;
(3)写出酸性条件下H2O2和Na2SO3溶液反应的离子方程式:H2O2 SO32-=SO42- H2O;
(4)写出酸性条件下H2O2和NaI溶液反应的离子方程式:H2O2 2I- 2H =2H2O I2;
环节二:一周后的巩固内容
(一)次氯酸、次氯酸盐为什么具有强氧化性而大行其道
1.次氯酸
(1)写出HClO溶液和SO2反应的离子方程式:HClO SO2 H2O=Cl- SO42- 3H ;
(2)写出HClO和FeSO4溶液反应的离子方程式:HClO 2Fe2 H =2Fe3 Cl- H2O;
(3)写出HClO和Na2S溶液反应的离子方程式:HClO S2- H =Cl- S↓ H2O;
(4)写出HClO和Na2SO3溶液反应的离子方程式:HClO SO32-=Cl- SO42- H ;
(5)写出HClO和NaI溶液反应的离子方程式:HClO 2I- H =Cl- H2O I2;
2.次氯酸盐
(1)写出NaClO溶液和SO2反应的离子方程式:ClO- SO2 H2O=Cl- SO42- 2H ;
(2)写出Ca(ClO)2溶液和足量SO2反应的离子方程式:
Ca2 2ClO- 2SO2 2H2O=2Cl- SO42- 4H CaSO4↓;
(3)写出NaClO和FeSO4溶液反应的离子方程式:3ClO- 6Fe2 3H2O=4Fe3 3Cl- 2Fe(OH)3↓;
(4)写出NaClO和Na2S溶液反应的离子方程式:ClO- S2- H2O=Cl- S↓ 2OH-;
(5)写出NaClO和Na2SO3溶液反应的离子方程式:ClO- SO32-=Cl- SO42-;
(6)写出NaClO和NaI溶液反应的离子方程式:ClO- 2I- H2O=Cl- I2 2OH-;
(7)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:3ClO- 2Fe3 10OH-=6FeO42- 3Cl- 5H2O;
(8)工业上经常用次氯酸盐氧化FeCl3制取高铁酸盐。完成"氧化"过程中反应的离子方程式:3ClO- 2Fe3 10OH-=6FeO42- 3Cl- 5H2O;
(二)Cl2江湖一姐——Cl2与水反应的价值分析
(1)写出Cl2和FeSO4溶液反应的离子方程式:Cl2 2Fe2 =2Fe3 2Cl-;
(2)写出Cl2和Na2S溶液反应的离子方程式:Cl2 S2-=2Cl- S↓;
(3)写出Cl2和Na2SO3溶液反应的离子方程式:Cl2 SO32-=Cl- SO42-;
(4)写出Cl2和NaI溶液反应的离子方程式:Cl2 2I-=I2 2Cl-;
(5)写出Cl2和Na2S2O3反应的离子方程式:4Cl2 S2O32- 5H2O=8Cl- 2SO42- 10H ;
(6)写出碱性条件下Cl2和Na2S2O3反应的离子方程式:4Cl2 S2O32- 10OH-=4Cl- 2SO42- 5H2O;
(7)写出Cl2和FeBr2反应的离子方程式:2Cl2 2Fe3 2Br-=2Fe3 4Cl- Br2;
(三)NO2江湖二弟——NO2与水反应的价值分析
(1)写出NO2和FeSO4溶液反应的离子方程式:NO2 2Fe2 2H =2Fe3 NO H2O;
(2)写出NO2和Na2S溶液反应的离子方程式:NO2 S2- 2H =NO S↓ H2O;
(3)写出NO2和Na2SO3溶液反应的离子方程式:NO2 SO32-=NO SO42-;
(4)写出NO2和NaI溶液反应的离子方程式:NO2 2I- 2H =NO H2O I2;
(5)写出NO2和Na2S2O3反应的离子方程式:4NO2 S2O32- H2O=2NO 2SO42- 2H ;
环节三:一个月后的巩固内容
(一)HNO3宝刀未老
1.稀HNO3与Cu反应的价值分析
(1)写出HNO3(稀)和FeSO4溶液反应的离子方程式:NO3- 3Fe2 4H =3Fe3 NO↑ 2H2O;
(2)写出HNO3(稀)和Na2S溶液反应的离子方程式:2NO3- 3S2- 8H =2NO↑ 3S↓ 4H2O;
(3)写出HNO3(稀)和Na2SO3溶液反应的离子方程式:2NO3- 3SO32 2H -=2NO↑ 3SO42- H2O;
(4)写出HNO3(稀)和NaI溶液反应的离子方程式:2NO3- 6I- 8H =2NO↑ 4H2O 3I2;
(5)写出HNO3(稀)和Na2S2O3反应的离子方程式:8NO3- 3S2O32- 2H =8NO↑ 6SO42- H2O;
(6)写出HNO3(稀)和 FeS反应的离子方程式:NO3- FeS 4H =Fe3 NO↑ S 2H2O;
(7)写出HNO3(稀)和 Cu2S反应的离子方程式:4NO3- 3Cu2S 16H =6Cu2 3S 4NO↑ 8H2O;
(8)写出HNO3(稀)和Fe反应的离子方程式:NO3- Fe 4H =Fe3 NO↑ 2H2O;
2.浓HNO3与Cu反应的价值分析
(1)写出HNO3(浓)和FeSO4溶液反应的离子方程式:NO3- Fe2 2H =Fe3 NO2↑ H2O;
(2)写出HNO3(浓)和Na2S溶液反应的离子方程式:2NO3- S2- 4H =2NO2↑ S↓ 2H2O;
(3)写出HNO3(浓)和Na2SO3溶液反应的离子方程式:2NO3- SO32 2H -=2NO2↑ SO42- H2O;
(4)写出HNO3(浓)和NaI溶液反应的离子方程式:2NO3- 2I- 4H =2NO2↑ 2H2O I2;
(5)写出HNO3(浓)和Na2S2O3反应的离子方程式:8NO3- S2O32- 6H =8NO2↑ 2SO42- 3H2O;
(6)写出HNO3(浓)和 FeS反应的离子方程式:3NO3- FeS 6H =Fe3 3NO2↑ S 3H2O;
(7)写出HNO3(浓)和 Cu2S反应的离子方程式:4NO3- Cu2S 8H =2Cu2 S 4NO2↑ 4H2O;
(8)写出HNO3(浓)和Fe反应的离子方程式:3NO3- Fe 6H =Fe3 3NO2↑ 3H2O;
环节四:六个月后的巩固内容
(一)酸性KMnO4王道称霸
(1)写出酸性KMnO4和FeSO4溶液反应的离子方程式:MnO4- 5Fe2 8H =5Fe3 Mn2 4H2O;
(2)写出酸性KMnO4和Na2S溶液反应的离子方程式:2MnO4- 5S2- 16H =2Mn2 5S↓ 8H2O;
(3)写出酸性KMnO4和Na2SO3溶液反应的离子方程式:2MnO4- 5SO32 6H -=2Mn2 5SO42- 3H2O;
(4)写出酸性KMnO4和NaI溶液反应的离子方程式:2MnO4- 10I- 16H =2Mn2 8H2O 5I2;
(5)写出酸性KMnO4和Na2S2O3溶液反应的离子方程式:
8MnO4- 5S2O32- 14H =8Mn2 10SO42- 7H2O;
(6)写出酸性KMnO4和 FeS反应的离子方程式:3MnO4- 5FeS 24H =5Fe3 3Mn2 5S 12H2O;
(7)写出酸性KMnO4和 Cu2S反应的离子方程式:4MnO4- 5Cu2S 32H =10Cu2 5S 4Mn2 16H2O;
(8)写出酸性KMnO4和H2O2溶液反应的离子方程式:2MnO4- 5H2O2 6H =2Mn2 5O2↑ 8H2O;
(9)写出酸性KMnO4和HCl溶液反应的离子方程式:2MnO4- 10Cl- 16H =2Mn2 5Cl2↑ 8H2O;
(10)写出酸性KMnO4和HBr溶液反应的离子方程式:2MnO4- 10Br- 16H =2Mn2 5Br2 8H2O;
(11)写出酸性KMnO4和HI溶液反应的离子方程式:2MnO4- 10I- 16H =2Mn2 5I2 8H2O;
(12)写出酸性KMnO4和H2C2O4溶液反应的离子方程式:
2MnO4- 5H2C2O4 6H =2Mn2 10CO2↑ 8H2O;
(13)写出酸性KMnO4和K2C2O4溶液反应的离子方程式:
2MnO4- 5C2O42- 16H =2Mn2 10CO2↑ 8H2O;
(二)酸性K2Cr2O7雄心壮志
(1)写出酸性K2Cr2O7和FeSO4溶液反应的离子方程式:Cr2O72- 6Fe2 14H =6Fe3 2Cr3 7H2O;
(2)写出酸性K2Cr2O7和Na2S溶液反应的离子方程式:Cr2O72- 3S2- 14H =2Cr3 3S↓ 7H2O;
(3)写出酸性K2Cr2O7和Na2SO3溶液反应的离子方程式:Cr2O72- 3SO32 8H -=2Cr3 3SO42- 4H2O;
(4)写出酸性K2Cr2O7和NaI溶液反应的离子方程式:Cr2O72- 6I- 14H =2Cr3 7H2O 3I2;
(5)写出酸性K2Cr2O7和Na2S2O3溶液反应的离子方程式:
4Cr2O72- 3S2O32- 26H =8Cr3 6SO42- 13H2O;
(6)写出酸性K2Cr2O7和 FeS反应的离子方程式:Cr2O72- 2FeS 14H =2Fe3 2Cr3 2S 7H2O;
(7)写出酸性K2Cr2O7和 Cu2S反应的离子方程式:2Cr2O72- 3Cu2S 28H =6Cu2 6S 4Cr3 14H2O;
(8)写出酸性K2Cr2O7和H2O2溶液反应的离子方程式:2Cr2O72- 3H2O2 8H =2Cr3 3O2↑ 7H2O;
(9)写出酸性K2Cr2O7和HCl溶液反应的离子方程式:Cr2O72- 6Cl- 14H =2Cr3 3Cl2↑ 7H2O;
(10)写出酸性K2Cr2O7和HBr溶液反应的离子方程式:Cr2O72- 6Br- 16H =2Cr3 3Br2 7H2O;
(11)写出酸性K2Cr2O7和HI溶液反应的离子方程式:Cr2O72- 6I- 16H =2Cr3 3I2 7H2O;
(12)写出酸性K2Cr2O7和H2C2O4溶液反应的离子方程式:
Cr2O72- 3H2C2O4 8H =2Cr3 6CO2↑ 7H2O;
(13)写出酸性K2Cr2O7和K2C2O4溶液反应的离子方程式:
Cr2O72- 3C2O42- 14H =2Cr3 6CO2↑ 7H2O;
二、方法比努力还重要
方法是从学习中悟出来的,到一定程度时方法有时比知识更重要,就如复杂的氧化还原反应的书写问题,很多高三的学生还是无能为力的,这不是说他知识储备不够,而是没有找到解决问题的办法。
阿基米德说:"给我一个支点,我可以撬动整个地球。"这个支点就是一个恰当的工具,这是我们解决问题的主要方式方法。如果方法正确,即使问题很难,也有可能解决。相反,如果没有合适的方式方法,即使再怎么努力工作,它也只会浪费能源和资源,不会产生任何好的结果。
而恰恰我们老师往往只关注的是知识的落实,而不去思考解决问题的办法,因而也只限于浅层学习的阶段,浅层学习只是关注知识的习得,到头来学生只是成为知识的容器,而无法用所学知识去解决复杂的或者陌生的问题。
所以,在高三复习课教学设计上,知识复习往往与能力培养是分离的,实际上没有方法的渗透。知识讲解的同时没有解决问题方法跟进,更没有体现方法问题的设计、典型例题的分析与典型习题训练。没有形成有方法渗透的"内容→问题→例题→习题"教与学的方式。
如果在处理具体问题上有能引到位策略,体现引导到位的策略就是引出教材中没有的内容,引出有价值的内容,引出一点能否带动一片,引出之后又很好的解决与落实。通过培养学生批判性思维,达到知识构建和转化,形成一定的迁移能力,就能达到深度学习的阶段。