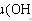3CH≡CH+10KMnO4+2KOH→6K2CO3+10MnO2+4H2O
其中K2CO3是由CO2与KOH作用而生成的。
在酸性溶液中:
5R-C≡CH+8KMnO4+12H2SO4→
5RCOOH+5CO2+4K2SO4+8MnSO4+12H2O
CH≡CH+2KMnO4+3H2SO4→2CO2+4H2O+K2SO4+2MnSO4
27.为什么制取溴苯,开始时反应较慢?一般制得的溴苯都不纯净,怎样使它净化?
苯与溴在铁催化下,可生成溴苯:

这个反应实际上起催化作用的不是铁,而是三溴化铁,并进而生成四溴化铁复合离子。这个过程需要一定的时间,致使反应一开始并不明显。
反应完毕后,反应混和物中含有溴、三溴化铁、氢溴酸以及溴苯等。要制得较纯净的溴苯,可先将反应混和物倒入冷水中,由于溴比水重,溴化铁、氢溴酸溶于水,这样可把大量杂质除去。因为溴在溴苯中的溶解度大于在水中的溶解度,所以难以用水将溴完全洗净。为了进一步提纯溴苯,可将不纯的溴苯先放在分液漏斗中用水洗,然后再用稀氢氧化钠溶液洗,NaOH与Br2作用,生成溶于水的NaBr和NaBrO,使溴除去。最后再用水洗,然后加以干燥,即可得到较纯的溴苯。
28.苯进行硝化时,为什么要加入浓硫酸?
过去有人认为硫酸是起着脱水的作用,但是又发现硫酸的浓度约在90%(含水10%)时,反应的速度最大。高于或低于这个浓度,都会使反应速度降低,可见硝化反应的速度主要决定于混和酸中硫酸的浓度,而不在于它的脱水性能。这一点还可从其它事实得到证明。例如。在硝化过程中加入五氧化二磷(强脱水剂),对反应速度并不发生影响。
经过其它实验表明,浓硫酸在反应中不仅是脱水剂,而且与硝酸作用生成硝酰正离子NO2 (或叫做硝基正离子),硝酰正离子(NO2 )是进攻苯环的试剂。由此可见,浓硫酸在硝化反应中除了脱水作用外,还能使硝酸离解,促使硝酸完全转变为硝酰正离子;硝酰正离子和苯生成的正碳离子中间体受HSO4-作用,很容易失去一个质子(H )完成取代反应过程,生成取代产物硝基苯。
29.在实验室中如何制备无水乙醇?
普通酒精的含量为95.57%(质量),尚含4.43%的水,用直接蒸馏的方法不能把这部分水除掉。因为95.57%的酒精和4.43%的水组成一恒沸混和物,沸点是78.15℃,把这种混和物蒸馏时,气相和液相的组成不发生变化,即乙醇和水始终以这个混和比率同时蒸出。因此,要想进一步除去水,必须采用其它方法。但不能用无水氯化钙来干燥,因为氯化钙和乙醇能形成醇合物。
实验室制备无水乙醇时,在95.57%的酒精中加入新制的生石灰加热回流,使酒精中的水跟氧化钙作用,生成不挥发的氢氧化钙来除去水分。然后再蒸馏,这样可得到99.8%的无水酒精,沸点78.5℃。如果要制备绝对无水的酒精,可以在95.57%的酒精内加苯后蒸馏。因为18.4%乙醇,74.1%苯和7.4%水的混和液的沸点比这三种纯液体的沸点都低,为65℃。在这时收集到的馏分是乙醇、苯和水的混和物,水可全部蒸出。以后在78.5℃收集到的馏分就是绝对酒精。
30.苯酚跟溴水反应时,为什么有时得不到白色的三溴苯酚?
实验中使用饱和的溴水,在常温下立刻发生反应,会生成2、4、6-三溴苯酚的白色沉淀。但有时实验中却出现了黄色沉淀,这是因为在过量的溴水中,三溴苯酚可以继续和次溴酸(溴水中存在)作用生成黄色的2、4、4、6-四溴环己二烯酮。如用2%的氢碘酸(或亚硫酸氢钠溶液)处理,可重新还原为2、4、6-三溴苯酚。
31.为什么不能用金属钠来区别乙醇、乙醛和丙酮?应该选择什么试剂来区别它们?
怎样区别乙醇、乙醛和丙酮?有的读物上把答案写成:“与钠反应能产生氢气的为乙醇;发生银镜反应的是乙醛;余下的一种为丙酮。”这与实际情况是不相符的,因为乙醛和丙酮也能与金属钠反应,有氢气放出。

乙醛和丙酮分子中由于羰基(C=O)的吸电子作用,使α-碳上的氢原子也很活泼,所以它们跟金属钠都能反应。
区别乙醇、乙醛和丙酮时,可以先用银氨溶液作试剂,能发生银镜反应者为乙醛,余者为乙醇和丙酮。再用酸性高锰酸钾溶液区别,乙醇有还原性,能使紫红色的高锰酸钾溶液立即褪色,本身被氧化成乙酸,丙酮则很难被高锰酸钾氧化。