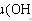2KCl+MnO2+O2↑
有时生成的氯化钾带有紫红色,说明了反应过程中有MnO4-存在。
“白雾”是氯酸钾受热分解生成的氯化钾以微粒分散在氧气中的原因。
但是,有的文献认为,在氯酸钾受热分解反应机理是:
2KClO3+4MnO2

2KCl+2MN2O7
2Mn2O7

4MnO2+3O2↑持这种看法的,对于为什么存在氯气的气味得不到应有的解释.
5.在实验室中制取氢气时,锌粒表面的黑色物质是什么?
将锌粒和稀硫酸反应制取氢气时,经常发现残余的锌粒表面附着一层黑色的物质,或者在锌粒全部溶解后看到有黑色的悬浮物残留在液体中。不纯锌粒中常含有Pb、Bi、Cu、Sn等杂质,当锌粒和酸发生反应时,锌中所含的Pb、Bi、Cu、Sn等较不活泼的金属杂质就游离出来,成微粒状态而呈黑色,并部分沉积在锌粒表面。它们能形成无数微小的原电池,对氢气发生的速度起促进作用。
6.电解水时为什么要加入少量电解质?
从纯水的导电实验测得,在25℃时,纯水中H 离子和OH-离子的浓度等于10-7摩/升。因此,实际上观察不到水的电解现象。这是因为,当H 离子在阴极上得到电子而生成氢气时,破坏了附近水的电离平衡,最终使阴极附近的OH-离子的数目相对地增多,这就使阴极附近的溶液带负电,它会吸引其它的H 离子并阻止H 离子继续在阴极上放电。阳极的情况与此相仿。若在水中加入少量某种强电解质,由于这些强电解质在溶液中全部电离,离子数目增多,在电场的影响下分别向两极移动,这样,水在电解时,阴阳两极附近的溶液里离子的电荷得到平衡,使水的电解能继续进行。
以纯水中加入Na2SO4通电分解为例,在水溶液中存在着Na 、H 、SO42-、OH-四种离子。根据它们电极电位的高低,在阳极,OH-离子放电,产物是氧气。随着OH-离子不断放电,如前所述,阳极附近聚集了相对多的H 离子时,由于SO42-离子不断迁移到阳极附近,使阳极附近溶液里离子的电荷得到了平衡。在阴极,H 离子放电,产物是氢气。同理,阴极附近溶液里离子的电荷也得到平衡。这样,水的电离平衡就不断向右移动,H 离子和OH-离子不断地在两极上放电,但Na2SO4并不发生电解,它只是起着使电极附近电解溶液里的电荷迅速得到平衡,从而使水的电解能继续进行的作用。
7.电解水时为什么收集的氢气和氧气体积之比不恰是2∶1?怎样克服?
电解水时,氧气的体积常小些,其原因主要有二:
(1)氢、氧两种气体在水中的溶解度不同。氧气的溶解度稍大些。
(2)电极的氧化、电极产生副反应等。如用稀硫酸溶液作电解液,有人认为有下列副反应发生:
H2SO4=H +HSO4-
在阴极:2H +2e=H2
在阳极:2HSO-2e=H2S2O8(过二硫酸)
H2S2O8+H2O=H2SO4+H2SO5(过一硫酸)
H2SO5+H2O=H2O2+H2SO4
生成的过氧化氢在酸性溶液中较稳定,不易放出氧气。
克服的办法是,在电解液中加入碱比加入酸的误差会小些。或者事先将电解液用氧气饱和,可以消除因溶解度不同而产生的误差。
8.为什么结晶时,有些盐带有结晶水,有些盐不带结晶水?
当盐溶解在水中时,阴离子和阳离子会分别吸引极性水分子的正极和负极一端,从而形成水合离子。阳离子通常都比阴离子小,所以与水分子间的吸引力远比阴离子强,能形成比较稳定或相当稳定的水合离子,以致有些盐从溶液中结晶析出时,晶体内仍带有一定个数的水分子。
阳离子水合能力的大小,主要决定于阳离子的大小和所带电荷的多少。阳离子的半径越小,电荷越多,水合能力就越大。在碱金属中,除半径小的Li 、Na 离子能形成水合离子时,其余的K 、Rb 、Cs 离子都不易形成水合离子。对碱土金属来说,由于电荷增多,半径减小,形成水合离子的倾向增大。不过这种倾向,同样随着碱土金属离子半径的增大而减小。阳离子所吸引的水分子数目同样与半径和电荷有关,半径较大、电荷较多的阳离子,既有较强的水合倾向,又能吸引较多的水分子。
9.氯水和碘化钾溶液反应,为什么有时看不到紫黑色的碘析出?
氯水和碘化钾溶液反应的化学方程式如下:
Cl2+2Kl=2KCl+I2
由此可见,反应中应见到有紫黑色的碘析出。但往往看到的是溶液呈棕红色或无色的现象。
如果碘化钾溶液过量,那末生成的碘还未来得及沉析就会与溶液中多余的碘化钾反应而生成棕红色的多碘化物:
KI+I2=KI3
如果氯水过量,那么生成的碘就将进一步被氧化为碘酸:
I2+5Cl2+6H2O=2HIO3+10HCl
所以,溶液呈现棕红色是由于碘化钾溶液过量引起的,而溶液为无色则是由于氯水过量引起的。
10.在实验室配制碘的水溶液通常不是将碘溶于水,而是将碘溶于碘化钾溶液,这是为什么?
固态碘是非极性分子晶体,难溶于极性较强的水中,在25℃时,1升水中只能溶解0.3克碘。实验室使用的碘水要求有比较大的浓度。为了得到浓度较大的碘水,可先向水中加入少量碘化钾晶体,然后再加入碘的晶体。这是由于在含有碘离子的溶液中,每个碘离子可以跟一个碘分子结合,生成三碘离子I3-。生成的I3-离子能够离解成碘和碘离子,溶液中有下列平衡存在:
I-+I2⇌I3
当反应需要碘时,上述平衡即向左方移动,使溶液内有碘供应,所以含有I3-离子溶液的性质与含有I2的溶液即碘水的性质相似。
11.氯水和硫化钠溶液反应时,为什么往往看不到乳黄色浑浊现象?
氯水和硫化钠溶液反应的化学方程式如下:
Cl2+Na2S=2NaCl+S↓
由此可见,反应中应有乳黄色浑浊现象产生,表明有硫析出。但往往看到的是溶液呈黄色或无色的现象。
如果硫化钠溶液过量,那末反应中产生的单质硫就会继续和硫化钠反应而生成多硫化钠Na2Sx(x=2~5),多硫化钠能溶于水,这时溶液呈黄色。
如果氯水过量,那末反应中产生的单质硫会进一步氧化为H2SO4。反应式如下:
S+3Cl2+4H2O=H2SO4+6HCl
可知氯水和硫化钠溶液反应得不到硫的原因是由于硫化钠或氯水过量所引起的。
12.铜与浓硫酸共热时产生的黑色物质是什么?
国外的化学工作者指出铜和浓硫酸共热时最常见到的反应产物是硫酸铜和硫化亚铜。
在80℃以后,随着温度的提高,反应中硫酸铜的生成逐渐增加,而硫化亚铜的生成却逐渐减少,到达270℃时,硫化亚铜在反应中完全消失。反应
Cu+2H2SO4

CuSO4+SO2↑ 2H2O
在各种温度都占优势,而在270℃以上时则是唯一的反应。另一个反应
5Cu+4H2SO4