如果患者已经身处癌症晚期,试遍所有药物都无法抑制病情,此时出现了一种新颖的疗法,只需要一针就能有效缓解病情,有多少人愿意尝试?相信大多数患者都愿意殊死一搏。那么如果这项疗法的售价高达120万元呢?还有多少患者愿意尝试,或者说能够负担?
以上正是嵌合抗原受体 T细胞免疫疗法(CAR-T) 的尴尬处境。
从患者角度思考,CAR-T疗法拥有能够化腐朽为神奇的力量,但同时它过高的售价依然让很多癌症患者望而生怯。
在过去,CAR-T疗法或许是一个离我们很远的东西,但随着复星凯特和药明巨诺的两款CAR-T产品去年在国内获批,中国已经正式进入CAR-T元年,投资者开始聚焦这个新兴领域。
2022年10月18日,科济药业CT053的上市申请获得中国国家药品监督管理局( NMPA )的受理,这也意味着 国内市场即将迎来第三款CAR-T疗法 ,同时也是第一款针对BCMA靶点的CAR-T疗法,科技药业股价也开启连续上涨。
作为全球最热门的疗法之一,CAR-T有着极为复杂的原理,但为了降低投资者对其理解的难度,我们将竭力用最简洁文字,来让投资者能够全面认识这个有望彻底改变人类与癌症关系的突破性疗法。
01 开端源点:“攻克”晚期癌症2010年初,3名被医生宣告“无药可医”的晚期慢性淋巴细胞白血病( CLL )患者接受了一次史无前例的试验。
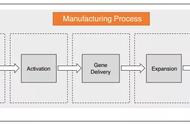
试验需要从患者外周血内提取T细胞,然后通过基因工程技术给T细胞安装一个能够追踪癌细胞的导航( CAR ),再通过体外扩培养的方式进行扩增。在得到足够“改装”后的T细胞后,医生 将这些“改装”后的T细胞重新注射回病人体内以达到消灭癌细胞的目的 ,这正是如今的CAR-T疗法。

图:CAR-T 细胞疗法生产过程,来源:国盛证券
拥有十年白血病史的William Ludwig是第一个接受CAR-T疗法的患者,在注射“改装”T细胞的10天后,William一度出现了剧烈的副作用,甚至呼吸困难,就当所有人为William科学献身致敬时,他居然奇迹般的挺了过来。更让人震惊的是,William体内的癌细胞在一个月内消失了,甚至在随后十年的随访中,依然能够在它的血液中找到当初注射的“改装”T细胞。
虽说癌症无法治愈,但William确实在余生中摆脱了CLL的困扰。William并非个例,很多同样接受CAR-T疗法的患者病情也大幅缓解。
CAR-T疗法之所以高效,是因为其从本质改变了T细胞与癌细胞的结合路径。
人体内中,T细胞是主要的抗癌手段,正常T细胞完成抗癌需要同时具备两个条件。其一,T细胞表面的受体( TCR )需要识别到癌细胞表面的组织相容性复合体 ( MHC ) 所呈现的抗原肽片段;其二,T细胞还需要共刺激分子( CD28 )与提呈细胞( APC )表面的分子相结合。

图:T细胞活化路径,来源:招银证券
然而,很多癌细胞为了逃避免疫系统的监测,往往会通过调低MHC表达的方式,减少相关抗原的呈递,这就导致T细胞无法被活化,从而发生免疫逃逸。
CAR-T疗法正是解除了T细胞的这种限制。通过基因改造,拥有导航功能的CAR可以直接靶向癌细胞的相关靶点,即使其调低了MHC表达,但因为相关靶点的存在,它依然能够被CAR-T细胞识别并消灭。
02 行业发展:商业化的新纪元CAR-T疗效数据优异,甚至能“治愈”癌症,因此这种疗法一跃成为资本关注的焦点。
最先抓住CAR-T风口的是诺华,其研发的Kymriah于2017年8月31日获批,成为首款上市的CAR-T药物。不过,Kymriah并没有独占这个市场太长时间,仅仅两个月后,FDA就批准吉利德的Yescarta上市。
对比两款产品,他们靶点相同均靶向CD19靶点,但却采取了完全不同的设计方式,也分别布局两种并不相同的适用症。
在这里我们有必要介绍一下CAR-T细胞的组成结构。一个CAR-T 细胞主要有4部分组成:抗原受体结构、Spacer 结构域、跨膜结构域、共刺激分子序列。