1,价态规律
(1)元素处于最高价时只有氧化性;如:Fe3
元素处于最低价时只有还原性;如:S2-
元素处于中间价时既有氧化性又有还原性。 (但主要表现其中一种性质,如:Fe2 主要体现还原性)
(2)同种元素化合价越高,通常氧化性越强;
反之,化合价越低,还原性越强。
如氧化性:KMnO4 > K2MnO4 > MnO2 > MnSO4
2,强弱规律——根据反应方程式判断
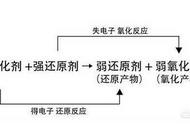
(1)氧化性:氧化剂>氧化产物
(2)还原性:还原剂>还原产物
3,优先规律 当一种氧化剂遇到多种还原剂时,还原性强的优先反应;
当一种还原剂遇到多种氧化剂时,氧化性强的优先反应。
例如:已知还原性Fe2 >Br-。
FeBr2溶液中通入少量Cl2时 Fe2 先被氧化,再通入Cl2 时 Br- 再被氧化。
4,价态转化规律
(1)同种元素不同价态之间的氧化还原反应,化合价的变化遵循“只靠拢,不交叉” 原则; 以元素相邻价态之间的转化最容易(邻位转化容易发生);
含相邻价态同种元素的物质之间不能发生氧化还原反应(中间没有价态自然不能归中)。
(2)歧化反应:同一物质中同种元素化合价同时升降(有一部分原子化合价升高还有一部分原子化合价较低),该反应又称反归中反应。 6KOH 3Cl2===KClO3 5KCl 3H2O
(3)归中反应:同种元素不同价态的物质反应时,化合价向中间靠拢 “高价+低价→中间价”,该反应又称反歧化反应。
5,电子守恒规律
在同一个氧化还原反应中: 还原剂化合价升高总数 = 氧化剂化合价降低总数 氧化剂得电子总数 =还原剂失电子总数