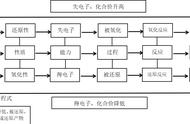
正确书写、理解记忆、熟练掌握化学方程式是很重要的。熟练掌握,不仅要求会写、会配平、会应用;而且要求全面理解有关物质间的物质的量比,快速、准确、高效地利用化学方程式中的定量、定性关系,随机应变地解决高考化学的实际问题。在高三化学复习过程中要做到以下三点:
一是要经常重现反思:具体物质的有关化学性质掌握了没有?如:钠元素及其化合物、氯元素及其化合物的有关化学方程式都会了吗?要如何去巩固?要如何去积累?要如何去记忆?等等。及时重现反思,可以强化记忆,克服遗忘;及时重现反思,可以强化积累,积少成多;及时重现反思,可以强化应用,解决问题。
二是要经常动手训练:书写某种元素及其化合物的有关化学方程式,如:Fe、Fe2 、Fe3 互变中的有关离子方程式,做到个个过关,熟能生巧。学会如何归类书写?掌握各类反应有何规律?如何迁移此规律来书写未学的化学方程式[Fe2 与Cr2O72-(H )反应]?等等。勤于动手训练,有助于归类总结;勤于动手训练,有助于掌握规律;勤于动手训练,有助于迁移应用。
三是要经常分析理解:平时训练中,化学方程式书写错误或写不来的原因何在?如何纠错?如何提高书写的准确率?等等。细心分析理解,可以避免类比失误,张冠李戴;细心分析理解,可以避免知识干扰,减少失分;细心分析理解,可以确保规范表述,准确答题。
目的:熟练并正确书写有关化学用语,达到随便让你写一个你学过的化学方程式,你不用想太久就能直接写的程度,以提高化学解题效率和提高高考化学成绩。
训练:下列各反应均有 NH3产生,试分析原因,并写出有关化学方程式:
(1)NH4Cl和消石灰固体加热
(2)NH4Cl和 NaOH固体研磨
(3)NH4Cl和 NaOH溶液加热
(4)NH4NO3和Ba(OH)2浓溶液混合
(5)亚硫酸铵稀溶液和KOH 稀溶液混合
(6)NH4Cl固体加热
(7)碳铵固体加热
(8)浓氨水加热
(9)氨水中加入碱石灰或生石灰或氢氧化钠固体
(10)(NH4)2SO4浓溶液中加入Na2O2固体
(11)NH4Cl固体和Na2O2固体共热
(12)氮气和氢气在一定条件下合成氨
一、根据反应现象书写化学方程式
例1.已知NH4CuSO3与足量的2 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生有刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.1 mol NH4CuSO3完全反应转移0.5 mol电子
D.有刺激性气味的气体是氨气
解析:根据现象①、②、③所对应的生成物分别是:Cu、SO2、CuSO4,由此可写出反应的化学方程式为:2NH4CuSO3 2H2SO4==Cu↓ (NH4)2SO4 2SO2↑ CuSO4 2H2O,可见反应中,电子转移发生在NH4CuSO3中的 1价Cu元素之间,与S元素无关,2molNH4CuSO3反应转移1mol电子,故1mol NH4CuSO3反应转移0.5mol电子,故C选项正确。
例2.若向四羟基合铝酸钠溶液中逐滴加稀盐酸至过量,立即产生白色沉淀,然后逐渐溶解,最后沉淀消失;若向盐酸中逐滴加四羟基合铝酸钠溶液至过量,从无沉淀到出现沉淀,最后沉淀不消失;请写出整个实验过程有关的离子方程式。
解析:根据现象知:反应开始盐酸不足,产生白色沉淀是Al(OH)3,Al(OH)3有两性又溶于过量盐酸,故向Na[Al(OH)4]溶液中逐滴加稀盐酸至过量的的离子方程式为:[Al(OH)4]- H ==Al(OH)3↓ H2O,Al(OH)3 3H ==Al3 3H2O;向盐酸中逐滴加Na[Al(OH)4]溶液至过量,反应开始盐酸过量,不产生沉淀,随后Na[Al(OH)4]溶液过量与溶液中的Al3 离子发生双水解反应,整个实验过程有关的离子方程式为:[Al(OH)4]- 4H ==Al3 4H2O,Al3 3[Al(OH)4]-==4Al(OH)3↓。
二、由题设信息书写化学方程式
例1.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在 1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是_______。
A.制气轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)根据元素周期律知识,请写出氮化硅的化学式_______。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式_____________________________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为___________________________________。
解析:(1)因氮化硅硬度大、熔点高,可以制机器、模具等。故选A、C、D。
(2)氮的非金属性比硅强,故在氮化硅中,N显-3价,Si显 4价,化学式为Si3N4。
(3)根据题设信息Si3N4可与氢氟酸反应,这是硅的特性,由Si3N4的组成和化合价推测应生成SiF4和NH3。其化学方程式是:Si3N4 12HF == 3SiF4↑ 4NH3↑。
(4)根据题干信息知,氮化硅可用高纯硅与纯氮在1300℃反应获得,此反应可采用分合法理解为H2还原SiCl4制取硅,然后Si与N2在高温下反应生成Si3N4,
故反应的化学方程式是:3SiCl4 2N2 6H2

例2.在微电子工业中,氨的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 _。
解析:由题设信息:反应产物不污染环境,知生成物应是无污染的氧化产物N2和还原产物H2O,因此,氨水与双氧水发生氧化还原反应的化学方程式是:2NH3 3H2O2 == N2↑ 6H2O。
三、根据反应规律书写化学方程式
例1. SiHCl3和SiCl4一样,遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,试写出其水解的化学方程式: 。
解析:物质发生水解反应的共同规律是反应物中正电性原子或原子团、负电性原子或原子团分别与水中OH-、H 等价交换的反应。根据这一水解规律知,SiCl4中 4价Si与OH-结合生成H4SiO4(即H2SiO3),-1价Cl与H 结合生成HCl,SiCl4水解的化学方程式:SiCl4 3H2O=H2SiO3 4HCl↑;而SiHCl3与SiCl4相比,组成元素不同的是-1价H,它具有很强的还原性,易与H 结合生成H2,故SiHCl3水解的化学方程式:SiHCl3 3H2O == H2SiO3 3HCl↑ H2↑。
例2.氧化还原反应实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3- 4H 3e-→NO↑ 2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO43四种物质中的一种物质能使上述还原过程发生。
请写出该氧化还原反应的方程式: _____________________________。
解析:根据氧化还原反应规律,硝酸发生反应:NO3- 4 H 3e-→NO↑ 2H2O,反应中HNO3做氧化剂,另一种物质必做还原剂,而KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中KMnO4、Fe2(SO4)3中的Mn和Fe元素的化合价都已经达到最高价,常作氧化剂,Na2CO3中C元素也处于最高价,因此,只有Cu2O中的Cu元素化合价为+1价,处于中间价态,可做还原剂被强氧化剂HNO3氧化,Cu元素化合价升为+2价,氧化产物是Cu(NO3)2。其氧化还原反应的方程式为:3Cu2O+14HNO3 == 6Cu(NO3)2+2NO↑+7H2O。
四、根据定量观书写化学方程式
例1.分别写出FeBr2溶液与不同量的Cl2发生反应的离子方程式:
(1) FeBr2溶液与少量Cl2 反应
(2) FeBr2溶液与等物质的量的Cl2反应
(3) FeBr2溶液与过量Cl2反应
解析:(1) Fe2 还原性大于Br-,Fe2 优先被少量Cl2氧化,故离子方程式是:
2Fe2 +Cl2==2Fe3 +2Cl-。
(2) FeBr2与Cl2等物质的量反应时,Cl2能将Fe2 全部氧化、Br-部分氧化,故离子方程式是:
2Fe2 +2Br-+2Cl2==2Fe3 +4Cl-+Br2。
(3)足量的Cl2能将Fe2 、Br-全部氧化,故离子方程式是:
2Fe2 +4Br-+3Cl2==2Fe3 +6Cl-+2Br2。
例2.反应物的量的相对多少都会影响反应产物。请写出下列反应的离子方程式:
(1)含1 mol KOH的溶液与过量的Ba(HCO3)2溶液混合
(2)物质的量之比为1∶1的KOH溶液与Ba(HCO3)2溶液混合
(3)过量的KOH溶液与少量的Ba(HCO3)2溶液混合
解析:(1) Ba(HCO3)2过量,KOH不足,难以将HCO3-全部中和,只中和一个HCO3-,故生成BaCO3、KHCO3及H2O,Ba(HCO3)2不按组成比1∶2书写,正确的离子方程式为:
Ba2 HCO3- OH-==BaCO3↓ H2O。
(2) KOH与Ba(HCO3)2物质的量之比为1∶1时,仍是Ba(HCO3)2过量,故离子方程式仍为:
Ba2 HCO3- OH-==BaCO3↓ H2O。
(3) KOH过量,可将HCO3-全部中和,生成BaCO3、K2CO3及H2O,Ba(HCO3)2按组成比1∶2书写,正确的离子方程式为: Ba2 2HCO3- 2OH-==BaCO3↓ CO32- 2H2O。
五、根据动态观书写化学方程式
例1.一定量的铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅, 将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中。请写出有关反应的化学方程式。
解析:要从动态的观点认识铜与浓HNO3反应,随着反应不断进行,HNO3浓度变稀,同时还原产物由NO2气体变为NO气体,故气体颜色越来越浅,生成的混合气体与通入的O2在水中恰好完全溶解,说明两种氮的氧化物在水中均被O2氧化生成硝酸。整个过程涉及反应的化学方程式分别为:
Cu 4HNO3(浓)==Cu(NO3)2 2NO2↑ 2H2O,
3Cu 8HNO3(稀)==3Cu(NO3)2 2NO↑ 4H2O,
4NO2 O2 2H2O==4HNO3,
4NO 3O2 2H2O==4HNO3。
例2.铁、铝遇冷浓硫酸或冷浓硝酸发生钝化,加热时会发生什么反应?铁、铝过量时分别发生什么反应?请写出有关反应的化学方程式。
解析:加热后铁、铝与浓硫酸或浓硝酸均发生氧化还原反应,随着反应不断进行,Fe、Al与浓H2SO4反应生成的气体先是SO2后是H2,Fe、Al与浓HNO3反应生成的气体先是NO2后是NO,过量Fe还会与Fe3 盐发生氧化还原反应产生Fe2 盐,过量铝反应产物一样,从动态反应的思路出发,就容易得到正确结果。有关反应的化学方程式分别为:2Fe 6H2SO4(浓)

Fe Fe2(SO4)3==3FeSO4, Fe H2SO4==FeSO4 H2↑;
Fe 6HNO3(浓)

Fe 4HNO3(稀)== Fe(NO3)3 NO↑ 2H2O,Fe 2Fe(NO3)3== 3Fe(NO3)2;
2Al 6H2SO4(浓)