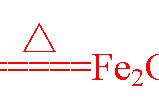专业高中化学教师,帮助您的孩子轻松学好高中化学。学好数理化,潇洒走天下。
近期有老师咨询氯化铁加NaOH后与H⁺反应还是和Fe³⁺反应?水解反应移动方向是什么的问题。本次给大家分析这个问题:
首先,要知道实际上盐类水解平衡是一个多重平衡叠加的总式子。请看资料:

《无机化学》 舒炼,鲁群岷,明智强主编
实际上盐类水解平衡是水的电离平衡与弱电解质的电离平衡(或弱电解质的沉淀溶解平衡)逆过程叠加得到的。也就是说它是2个平衡,我们为了分析的方便搞成一个来研究。氯化铁的水解平衡是由以下两个过程叠加而成的:

我们按两个平衡做一下分析,加入NaOH后平衡①逆向移动,就相当于氢氧根与氢离子反应了。加入NaOH平衡②正向移动,相当于铁离子与氢氧根反应了。所以从两个平衡角度看氢氧化钠既和H⁺反应又和Fe³⁺反应。很多老师还是“二极管思维”,非得要搞清氢氧根是先和氢离子、铁离子谁先反应?根据上述分析反应没有先后,应该同时都反应。如果说反应的量的多少,我们倒是可以做一下计算。假定FeCl3溶液起始pH=1.0加NaOH后变为pH=2.0,由于铁离子大概pH=2.7才沉淀完全,所以这时应该两个平衡均存在。

《配苏教版普通高中课程标准实验教科书 高中化学教学参考书 化学反应原理(选修) 2019年印刷》王祖浩主编
pH从1.0到2.0,c(H⁺)从0.1mol/L变为0.01mol/L,降低量为0.09mol/L。而根据氢氧化铁的Ksp计算出,pH=1.0时c(Fe³⁺)=Ksp(Fe(OH)₃)/c³(OH⁻)=2.6×10⁻³⁹/10⁻³⁹=2.6mol/L。当pH=2.0时c(Fe³⁺)=Ksp(Fe(OH)₃)/c³(OH⁻)=2.6×10⁻³⁹/10-36=0.0026mol/L。此时铁离子浓度降低量为2.5974mol/L。所以从计算角度看,氢氧化钠应该此时主要与铁离子反应。
根据上述分析计算,是否可以说由于氢氧化钠主要跟铁离子反应,那么水解平衡就是逆向移动呢?我认为并不能这样认为,因为水解反应由水的电离平衡与氢氧化铁沉淀溶解平衡逆过程复合叠加而成。平衡①逆向移动,H⁺转化成H2O,从水解总方程看是逆向移动。平衡②正向移动,Fe³⁺转化为Fe(OH)₃从水解总方程看是正向移动。由于H⁺浓度降低量远小于Fe³⁺浓度降低量,两相抵消后相当于正向移动。
其实平衡移动是一个宏观概念,不要去从微观上分析加了某个东西先跟谁反应后跟谁反应的问题。既然是盐类水解,盐少了,水解产物多了那就是正向移动。管他跟谁先反应干啥呢?实际是一般更大可能是加某种物质后,会跟多种微粒均发生反应,但是反应程度上有所不同。请看大学资料对酸碱度影响水解平衡移动方向的说法:

《无机化学 第2版》 曹凤歧主编

《无机化学》 吴小琼主编

《无机化学》 马祥志主编
从大学教材看,影响盐类水解的因素有温度、浓度、酸碱度。外加酸碱从对H⁺或OH⁻浓度影响角度分析移动方向。水解产生H⁺的盐,如果所加试剂导致H⁺浓度增大则逆向移动,如果导致H⁺浓度减小则正向移动;水解产生OH⁻的盐,如果所加试剂导致OH⁻浓度增大逆向移动,导致OH⁻浓度降低则正向移动。实际上严格来讲氯化铁溶液中Fe³⁺是以[Fe(OH)]2+、[Fe(OH)₂]⁺、[Fe(OH)₄]⁻、[Fe₂(OH)₂]⁴⁺等各种形式存在的多个平衡,加NaOH这些平衡都会移动,都乱套了。我们没必要去管这多个平衡咋移动,看结果就行,结果只要盐少了水解出的弱电解质多了就是促进了盐类水解(即正向移动)。
总结:氯化铁加氢氧化钠使其pH从1.0变为2.0,计算结果是氢氧根以跟铁离子反应为主,但是平衡移动我认为是正向移动。对于盐类水解外加酸碱时平衡移动方向的判断,是根据外加酸碱对酸碱度产生了什么影响,进而分析对水解产生的H⁺、OH⁻的浓度升降由此判断平衡移动方向。我认为平衡移动属于宏观问题,不能从微观上分析,非得根据所加试剂到底“先和谁反应”来判断移动方向。水解反应发生的主体是盐,水解产物主要是弱电解质。只要盐少了,弱电解质多了,那就是正向移动。
,