1,氢氧化亚铁
(1)白色固体,不溶于水。
(2)氢氧化亚铁具有还原性,容易被氧化
4Fe(OH)2+O2+H2O===4Fe(OH)3
与酸反应生成亚铁盐和水,Fe(OH)2+2H+===Fe2++2H2O(复分解反应,化合价不变化)。
2,氢氧化铁
(1)红褐色或红棕色固体,不溶于水。
(2)Fe(OH)3+3H+===Fe3++3H2O(复分解反应,化合价不变化)
(3)氢氧化铁受热可以分解

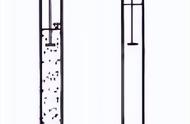
3,Fe(OH)3和Fe(OH)2的实验制备方法
实验操作:
在两支试管里分别加入少量的FeCl3和新制FeSO4溶液,然后滴入NaOH溶液,观察并记录现象。

实验现象:
甲中生成红褐色沉淀,久置不变色;乙中生成白色沉淀,且沉淀迅速变成灰绿色,最终变为红褐色。
实验结论:
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
制备时用新制的亚铁盐溶液如FeSO4溶液,它是为了防止Fe2+被氧化成Fe3+;滴管尖嘴插入液面以下,它是为了防止生成的Fe(OH)2与O2接触而被氧化。
所以制备Fe(OH)2要尽可能创造无氧环境以防止Fe(OH)2被氧化。