硫元素广泛存在于自然界中。
游离态硫:单质硫主要存在于火山口附近和地壳的岩层中。
化合态的硫:植物生长不可缺少的元素,蛋白质的组成成分;金属硫化物,如黄铁矿(FeS2)、黄铜矿(CuFeS2)等;地壳中受氧气、水的长期作用得到的硫酸盐,如石膏(CaSO4•2H2O)、芒硝(Na2SO4•10H2O)等;火山口气体中的硫可转化成H2S、SO2、SO3,遇水可转化成H2SO3和H2SO4。
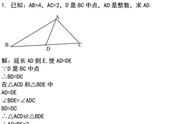
根据硫元素在周期表中的位置,结合元素周期律及硫原子的结构,推测硫元素的性质。
硫元素位于第三周期、第ⅥA族,从位置看是一种比较典型的非金属元素。
原子结构示意图:

最外层6个电子,容易得到2个电子,化合价为-2价,有较强的非金属性,单质有氧化性。
与同主族的氧元素相比,其原子多一个电子层,原子半径较大,得电子能力比氧弱,非金属性相对较弱,氧化性不如氧强。
与同周期的氯元素相比,其原子半径较大,得电子能力比氯弱,非金属性相对较弱,氧化性不如氯强。
由于其非金属性比氯、氧弱,主要化合价除了-2外,还有0、+4、+6等。
一、硫
物理性质:
俗名硫黄,黄色晶体,质地很脆易研成粉末,熔、沸点不高,密度不大。难溶于水、微溶于酒精、易溶于二硫化碳(CS2),可用二硫化碳洗涤玻璃仪器内壁上的固体硫。
硫有多种同素异形体,如斜方硫、正交硫等。硫分子有多种,最常见的是S8。
化学性质:
从物质类别看,硫是一种较典型的非金属单质,有较强的氧化性。
从元素化合价的角度看,硫的化合价为0,处于硫元素的中间价,化合价可以升高、降低,硫单质既有氧化性、又有还原性。
与许多金属单质及非金属单质发生化学反应。

小结:
硫的化学性质较活泼,与金属单质、氢气反应,化合价从0降低到-2,表现出氧化性。
但与氧气、氯气比较,和变价金属Fe、Cu反应时,只能生成低价的硫化亚铁(FeS)、硫化亚铜(Cu2S),而氧气、氯气反应可生成高价的Fe3O4、FeCl3、CuO、CuCl2。说明硫的氧化性没有氧气、氯气强,硫的非金属性比氧、氯要弱。
硫与氧气反应时,化合价从0升高到 4,作还原剂,表现出还原性(硫在空气中和氧气中燃烧都只生成SO2,不会生成SO3)。也可证明其氧化性不如氧气。
可见,硫既有氧化性、又有还原性。
硫的用途:
工业生产硫酸及硫酸盐、硫化物;在医疗上用于治疗皮肤病;用于橡胶的生产;用于火药的生产。
二、二氧化硫
实验:验证SO2的溶解性和水溶液的性质
操作:将充满SO2的试管塞上橡胶塞,倒立在水中,在水下拿掉橡胶塞(减少气体的泄漏),观察现象。等到液面不再上升时,在水下塞上橡胶塞,取出试管,将试管中的溶液滴到pH试纸上,观察颜色的变化。

现象:试管中的气体是无色,液面上升,但不能充满试管。试管中的溶液能使pH试纸显红色。
结论:说明二氧化硫是一种无色气体,易溶于水,水溶液呈酸性。
物理性质:
二氧化硫是无色有刺激性气味的气体,有剧毒,密度比空气大,易溶于水,一般1体积的水可溶解约40体积的二氧化硫。
化学性质:
1、酸性氧化物
二氧化硫的水溶液呈酸性,说明发生了化学变化,二氧化硫与水反应生成了亚硫酸(H2SO3)。但亚硫酸不稳定,同时又会分解成二氧化硫和水,上面的实验中气体不能完全吸收,也说明了这一点。