(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“===”、“”、“―→”、“↑”、“↓”等符号符合实际。
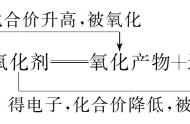
(4)三守恒:两边原子数、电荷数必须守恒,氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等。
(5)明类型:依据离子反应原理,分清类型,总结方法技巧。
(6)细检查:结合书写离子方程式过程中易出现的错误,细心检查。
2.离子方程式正误判断“4看”
(1)看拆分。易溶于水,易电离的强电解质用实际参加反应的离子表示;非电解质、弱电解质(弱酸、弱碱、水等),难溶物、气体、氧化物、单质等均用化学式表示。
(2)看反应。检查离子方程式中各项是否都有公约数,检查是否漏写某个反应或特殊条件。如Ba(OH)2与H2SO4的反应不能书写成Ba2++OH-+SO4(2-)+H+===BaSO4↓H2O。
(3)看守恒。离子方程式两边质量(原子)守恒;电荷守恒;得失电子守恒。
(4)看条件。注意限制条件的影响,如少量、过量等;注意酸碱性;注意氧化性、还原性的强弱关系。
3.限定条件的离子方程式的书写方法
(1)过量型:①按照组成比例写出不足量物质参加反应的离子方程式。如Ca(HCO3)2溶液与过量NaOH溶液反应,离子方程式中Ca2+与HCO3(-)的化学计量数之比一定是1∶2。②过量物质的离子满足不足量物质离子的反应需要,如①中反应,书写离子方程式时,OH-的化学计量数为2,满足HCO3(-)的反应需要。综合起来可得离子方程式:Ca2++2HCO3(-)+2OH-===CaCO3↓+CO3(2-)+2H2O。
(2)定量型:书写的关键是参加反应的离子严格按照给定的量之间的关系进行,如等物质的量的Ba(OH)2溶液与明矾溶液反应,Al3+、SO4(2-)、Ba2+和OH-的物质的量之比为1∶2∶1∶2,显然OH-不足量,然后按照以少定多的方法写出离子方程式:2Al3++3SO4(
2-)+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓。
(3)目标型:先写出能达到目标的主要离子方程式,然后用设“1”的方法使其完善。如向NaHSO4溶液中逐滴加入Ba(OH)2溶液,写出溶液呈中性时的离子方程式:先写出H++OH-===H2O,再设两物质各为1 mol,因NaHSO4===Na++H++SO4(2-Ba(OH)2===2OH-+Ba2+,所以当溶液中的H+被完全中和时,加入的Ba(OH)2只有0.5 mol。故离子方程式为SO4(2-)+2H++2OH-+Ba2+===BaSO4↓+2H2O。 (4)条件限定型:在书写离子方程式时,不同的限定条件下,生成物的形态不同,如NH4(+)与OH-反应,不加热时生成NH3·H2O,加热时有NH3产生;再如反应物为澄清石灰水或石灰乳,书写离子方程式时所用的符号不同,前者用离子符号,后者用化学式。