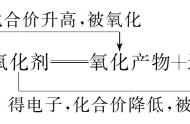
(3)氯碱工业生产流程图

2.电镀
下图为金属表面镀银的工作示意图,据此回答下列问题:

(1)镀件作阴极,镀层金属银作阳极。
(2)电解质溶液是AgNO3溶液等含镀层金属阳离子的盐溶液。
(3)电极反应:
阳极:Ag-e-===Ag+;
阴极:Ag++e-===Ag。
(4)特点:阳极溶解,阴极沉积,电镀液的浓度不变。
3.电解精炼铜
(1)电极材料:阳极为粗铜;阴极为纯铜。
(2)电解质溶液:含Cu2+的盐溶液。
(3)电极反应:
阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+;
阴极:Cu2++2e-===Cu。
4.电冶金
利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。

电极反应:
阳极:6O2--12e-===3O2↑;
阴极:4Al3++12e-===4Al。
5.金属的腐蚀与防护
1.金属腐蚀的本质
金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型
(1)化学腐蚀与电化学腐蚀
类型
化学腐蚀
电化学腐蚀
条件
金属跟非金属单质直接接触
不纯金属或合金跟电解质溶液接触
现象
无电流产生
有微弱电流产生
本质
金属被氧化
较活泼金属被氧化
联系
两者往往同时发生,电化学腐蚀更普遍
(2)析氢腐蚀与吸氧腐蚀
以钢铁的腐蚀为例进行分析:
类型
析氢腐蚀
吸氧腐蚀
条件
水膜酸性较强(pH≤4.3)
水膜酸性很弱或呈中性
电极反应
负极
Fe-2e-===Fe2+
正极
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
总反应式
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
联系
吸氧腐蚀更普遍
3.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法—原电池原理
a.负极:比被保护金属活泼的金属;
b.正极:被保护的金属设备。
②外加电流的阴极保护法—电解原理
a.阴极:被保护的金属设备;
b.阳极:惰性金属或石墨。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
—— END ——
注:本文来源网络,版权归原作者及原出处所有,若侵请联系我们。
——更多高中学习资料,请关注“16学生导学”,私信发“高中资料”免费获取。
关注 不错过你需要的教育资讯!