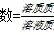不能直接在容量瓶内溶解或稀释样品,而应在烧杯中进行;
由于稀释或溶解操作通常会吸热或放热,所以要恢复至室温后再倒入容量瓶;
溶液转移到容量瓶中时要洗涤烧杯2-3次,否则会使浓度偏低;
定容液体物质时,量取样品的量筒内壁不需要冲洗;

定容时,视线要与凹液面保持水平,不能仰视或俯视;仰视导致溶液体积偏高,而俯视导致溶液体积偏低。
容量瓶不能长期储存溶液,更不能作为反应容器。

(4)溶液配制的误差分析
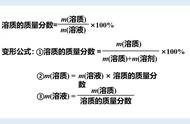
依据:根据公式 物质的量浓度=溶质物质的量/溶液体积 经过变形可得 =溶质质量/(溶质相对分子质量×溶液体积) 进行判断;
由于溶质相对分子质量不会改变,引起误差的只能是溶质质量或溶液体积改变所导致的。
根据实验操作,判断操作(或误操作)引起的是“m”的变化还是“V”的变化,以及是变大还是变小。

我们以配制NaOH溶液为例进行分析:
若称量时砝码和物品位置颠倒,并且在称量时使用了游码,使m减小,V不变,结果是浓度降低;
若称量时砝码和物品位置颠倒,但是在称量时未使用游码只使用了砝码,则m和V均不变,浓度也不变;
称量时间过长,NaOH潮解吸水,m减小,浓度降低;
用滤纸称量,NaOH腐蚀滤纸,其实就是部分NaOH与滤纸发生了反应,m减小,浓度降低;
NaOH溶液倒入容量瓶时溅出,m减小,浓度降低;
溶液未冷却至室温便注入容量瓶,由于溶液热胀冷缩的原因,引起V减小,所以浓度增加;