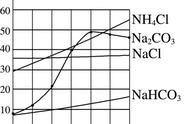
(1)P 点的含义是__________________________。
(2)若乙中混有少量甲,提纯乙的方法是__________。
(3)将 M 点的甲溶液转变为 N 点的甲溶液可采取的方法是____________________(写一种即可)。
(4)将 t3 ℃时等质量甲、乙的饱和溶液分别降温至 t1 ℃,对所得溶液的叙述正确的是________(多选)。
A.溶剂质量:甲>乙
B.析出晶体质量:甲>乙
C.溶质质量分数:甲<乙
4.【2017·郴州】海水中有着丰富的化学资源,人们可以从海水中提取出很多物质,如:氯化钠、镁等。图 K13
-5 就是利用海水提取氯化钠的大致过程:
图 K13-5

(1)图中①是__________(填"蒸发池"或"冷却池")。
(2)析出晶体后的母液是氯化钠的____________(填"饱和溶液"或"不饱和溶液")。
(3)实验室除去粗盐中难溶性杂质的主要实验步骤:
Ⅰ.溶解;
Ⅱ.________(填操作名称);
Ⅲ.蒸发。
上述三个步骤中,用到的同一种玻璃仪器的名称是______________,该玻璃仪器在步骤Ⅱ中的作用是
______________。
(4)提取粗盐后的母液中含有较多氯化镁,从母液中提取金属镁的过程大致如下:
母液 ――→氢氧化钙反应Ⅰ
氢氧化镁 ――→加入试剂 X反应Ⅱ
氯化镁 →…→ 金属镁
该 过 程 中 反 应 Ⅰ 的 基 本 反 应 类 型 是
________________________________________________________________________;
写出反应Ⅱ的化学方程式为____________________________________。
5.海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得
精盐的步骤是溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻地斜靠在____________一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还
可以采取的操作是______________。
②下列操作可能导致精盐产率偏高的是________(填字母)。
a.食盐没有完全溶解即过滤
b.过滤时液面高于滤纸边缘
c.器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。图 K13-6 是从海水中获得氯化镁溶液的流程。
图 K13-6

① 在 海 水 中 加 入 石 灰 乳 后 , 发 生 反 应 的 化 学 方 程 式 是
________________________________________________________________________。
②上述过程中试剂 A 与沉淀 B 发生的是中和反应,则试剂 A 是________(填名称)。
6.【2017·绥化】从海水中可制备纯碱和金属镁,其流程如图 K13-7 所示。
图 K13-7

(1)粗盐提纯时,每步操作都会用到的一种玻璃仪器是__________(填仪器名称)。
(2)粗盐水中主要含有 CaCl2、MgSO4等可溶性杂质,可加入下列物质:
a.适量的盐酸;
b.稍过量的 Na2CO3溶液;
c.稍过量的 Ba(OH)2溶液。
利用过滤等操作进行除杂,则加入这三种物质的先后顺序为________________(填字母)。
(3)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,最终可制得纯碱。请写出第Ⅲ步反应的化学方
程式:________________________________________________________________________
________________________________________________________________________。
(4)第Ⅴ步 Mg(OH)2与盐酸的反应__________(填"是"或"不是")中和反应。
参考答案
|夯实基础|
1.C
2.D [解析] 溶解度是在一定温度下,某固体溶质在 100 g 溶剂里达到饱和状态时所溶解的溶质质量。溶解度
不受溶剂质量、溶液质量多少的影响,与是否充分搅拌无关;恒温蒸发水,由于温度没有改变,则溶解度不变;溶解
度受温度的影响较大,升高温度,能改变硝酸钾的溶解度。
3.C
4.B [解析] 过滤时用到的实验仪器有烧杯、玻璃棒、铁架台、滤纸,还需要漏斗;蒸发结束后,应将蒸发皿
放在石棉网上冷却;要用玻璃棒将蒸发皿中的白色固体直接转移到纸上;粗盐提纯,只是将泥沙等不溶性杂质除去,
实验结束后所得到的白色固体中除氯化钠外,还含有氯化镁、氯化钙等杂质。
5.D [解析] 某温度下饱和溶液的质量分数为溶解度
溶解度+100 g×100%,20 ℃时饱和硝酸钾溶液中溶质的质量分数
为31.6 g
31.6 g+100 g×100%≈24%<28%,所以溶液从 60 ℃降温至 20 ℃,会有晶体析出。
6.C [解析] t2℃时,甲物质的溶解度是 40 g,所以甲的饱和溶液中溶质和溶剂的质量之比为 40 g∶100 g=2∶5;
降低温度,乙物质的溶解度减小,所以乙的饱和溶液从 t2℃降温到 t1℃,溶液仍饱和;t1℃时,甲、乙两种饱和溶液的
质量不能确定,所以饱和溶液中溶质的质量不能确定;t1℃时,甲、乙两物质的溶解度相等,所以甲、乙的饱和溶液分
别从 t2℃降温到 t1℃,两溶液中溶质质量分数相等。
7.(1)氯化钠 (2)不变 (3)降温结晶
8.(1)35.8 (2)增大 较小
(3)不饱和溶液 (4)36.0~36.3 g
|能力提升|
1.A [解析] 过滤时需将粗盐水沿玻璃棒倒入漏斗中,玻璃棒起引流作用,不能直接倒入漏斗中;蒸发时,蒸发
皿中有大量固体析出时就停止加热,用蒸发皿的余热将剩余水分蒸干;计算产率时,精盐要放在滤纸上进行称量,不
能直接放到托盘天平的托盘上。
2.C
3.(1)t2 ℃时,甲、乙两物质的溶解度相等
(2)蒸发溶剂(或蒸发结晶)
(3)增加溶质(或恒温蒸发溶剂)
(4)B、C
4.(1)蒸发池
(2)饱和溶液
(3)过滤 玻璃棒 引流
(4)复分解反应 Mg(OH)2+2HCl===MgCl2+2H2O
[解析] (1)氯化钠的溶解度受温度的影响不大,可用蒸发结晶的方法进行分离,故图中①是蒸发池。(2)析出晶体
后的母液,不能再溶解氯化钠,为氯化钠的饱和溶液。(3)实验室除去粗盐中难溶性杂质的主要实验步骤有:溶解、过
滤、蒸发;上述三个步骤中,用到的同一种玻璃仪器是玻璃棒,玻璃棒在步骤Ⅱ(过滤)中的作用是引流。(4)反应Ⅰ:
氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,是两种化合物相互交换成分生成两种新的化合物的反应,属于复
分解反应;反应Ⅱ将氢氧化镁转化成了氯化镁,应该加入盐酸,反应的化学方程式是 Mg(OH)2+2HCl===MgCl2+2H2O。
5.(1)①三层滤纸 间歇加热 ②b
(2)①MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
②盐酸
[解析] (1)①过滤操作中玻璃棒的末端要轻轻地斜靠在三层滤纸一边;为防止液滴飞溅,除用玻璃棒搅拌外,还
可采用间歇加热的方法。②食盐若没有完全溶解即过滤,则产率会减少;过滤时液面高于滤纸边缘,会有不溶性物质
进入滤液,使产率偏高;器皿上沾有的精盐没有全部转移到称量纸上,会使产率偏低。(2)①海水中含氯化镁,加入石
灰乳后,氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为 MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2。
②试剂 A 与沉淀 B 氢氧化镁发生中和反应后生成氯化镁和水,则试剂 A 为盐酸。
6.(1)玻璃棒 (2)cba (3)2NaHCO3=====△
Na2CO3+CO2↑+H2O (4)是
[解析] (1)粗盐的提纯有溶解、过滤、蒸发等步骤,每步都需要用到玻璃棒,溶解时用于搅拌以加速食盐的溶解,过
滤时用于引流,蒸发时用于搅拌以防止液体局部过热而引起液体飞溅。(2)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化
钠,氢氧化钡和硫酸镁反应生成硫酸钡沉淀和氢氧化镁,由于反应中加入药品都过量,故碳酸钠要在氢氧化钡之后加,
即碳酸钠不仅要除去氯化钙,还要除去过量的钡离子,而最后要用盐酸将过量的氢氧根离子、碳酸根离子除去,加入
的顺序是 cba。(3)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,化学方程式为 2NaHCO3=====△
Na2CO3+CO2↑+H2O。(4)
中和反应指的是酸和碱反应生成盐和水,氢氧化镁是碱,盐酸是酸,氢氧化镁和盐酸反应生成氯化镁和水,该反应是
中和反应。
,