学习目标
1.知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。
2.知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期表的应用价值。
1.元素周期律、元素周期系和元素周期表
(1)原子序数:按相对原子质量由小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号得到的序数。
(2)元素周期律:元素的性质随元素原子的核电荷数递增发生周期性递变的规律。
(3)元素周期系和元素周期表
按元素原子的核电荷数递增排列的序列叫元素周期系。元素周期表是呈现元素周期系的06(□)表格。元素周期系只有一个,元素周期表多种多样。
2.构造原理与元素周期表
(1)核外电子排布与元素周期系的基本结构
①根据构造原理得出的核外电子排布可以解释元素周期系中每个周期的元素数。第一周期从1s1开始,以1s2结束,只有两种元素。其余各周期总是从ns能级开始,以np结束,而从ns能级开始以np结束递增的核电荷数(或电子数)就等于每个周期里的元素数。
②周期、能级组、元素种类的对应关系
周期 | 对应能级组 | 对应能级组最多所能容纳的电子数 | 周期中所含元素种类 |
1 | 1s | 2 | 2 |
2 | 2s、2p | 8 | 8 |
3 | 3s、3p | 8 | 8 |
4 | 4s、3d、4p | 18 | 18 |
5 | 5s、4d、5p | 18 | 18 |
6 | 6s、4f、5d、6p | 32 | 32 |
7 | 7s、5f、6d、7p | 32 | 32 |
(2)核外电子排布与元素周期表的分区
按电子排布式中最后填入电子的能级的符号可将元素周期表分为s、p、d、f 4个区,而ⅠB、ⅡB族这2个纵行的元素的核外电子可理解为先填满了(n-1)d能级而后再填充ns能级而得名ds区。5个区的位置关系如下图所示:

3.元素在周期表中的位置与元素原子的结构、性质间的关系
(1)在元素周期表中,同族元素价层电子数相同,是同族元素性质相似的结构基础。
(2)长周期比短周期多出的元素,其原子的最外层电子数始终不超过2(Pd除外),所以它们全部是金属元素。
1.判断正误,正确的画“√”,错误的画“×”。
(1)元素原子的价电子就是最外层电子。( )
(2)除氦外,0族价层电子排布式为ns2np6。( )
(3)最外层电子排布式为ns1或ns2的元素一定为金属元素。( )
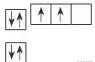
(4)价电子排布式为4s24p3的元素位于第四周期第ⅤA族,是p区元素。( )
(5)在元素周期表中,s区、d区和ds区的元素都是金属元素。( )
2.价层电子排布式为3d104s2的元素在周期表中的位置是( )
A.第三周期ⅦB族 B.第三周期ⅡB族
C.第四周期ⅦB族 D.第四周期ⅡB族
3.某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第________周期,该周期的元素种数是________。
(2)该元素处于元素周期表的第________族,该族的非金属元素种数是________。
(3)试推测该元素处于元素周期表的________区,该区包含族的种类是________。
1.核外电子排布与周期的划分
(1)原子核外电子排布与元素周期表中周期划分的本质联系

(2)每周期第一种元素的最外层电子的排布式为ns1。每周期结尾元素的最外层电子排布式除He为1s2外,其余为ns2np6。即最外层电子所在轨道的主量子数n与其对应的周期序数相等。
(3)周期数与电子层数的关系:周期数=电子层数。
2.核外电子排布与族的划分
族的划分与原子的价电子数目和价电子排布密切相关,一般情况下,同族元素原子的价电子数目相同。具体地讲:
(1)主族元素原子的价电子全部排布在最外层的ns或nsnp轨道上;主族元素的族序数与该元素原子的价电子数相同,也与该元素的最高正化合价相一致(F、O除外)。
(2)过渡元素的原子,价电子排布为(n-1)d1~10ns1~2(镧系、锕系、钯除外),由此可以看出,虽然同一副族元素的电子层数从上到下逐渐增加,但价电子排布却基本相同。
①ⅢB~ⅦB族元素原子的价电子数目等于族序数。
②Ⅷ族元素原子的价电子排布为(n-1)d6~9ns1~2(钯除外,为4d10)。
③ⅠB族和ⅡB族则是根据ns轨道上有1个还是2个电子来划分的。
(3)0族元素,除氦元素外,稀有气体元素原子的最外层电子排布均为ns2np6。这种全充满电子的结构是稀有气体元素原子具有特殊稳定性的内在原因。
[规律] 由元素的价电子排布判断其在周期表中的位置的规律
价电子排布 | x或y的取值 | 周期表中位置 |
nsx | x=1,2 | 第n周期xA族(说明:书写时,x、y应换成相应的罗马字母表示,下同) |
ns2npx | x=1,2,3,4,5 | 第n周期(2+x)A族 |
x=6 | 第n周期0族 | |
(n-1)dxnsy | x+y≤7 | 第n周期(x+y)B族 |
7<x+y≤10 | 第n周期Ⅷ族 | |
(n-1)d10nsx | x=1,2 | 第n周期xB族 |
易错警示
对价电子认识的误区
(1)价电子不一定是最外层电子,只有主族元素的价电子才是最外层电子。对于过渡元素还包括部分内层电子。
(2)元素的价电子数不一定等于其所在族的族序数,对部分过渡元素是不成立的。
(3)同一族元素的价电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价电子排布也不相同。
[练1] 某元素+3价离子的电子排布式为
1s22s22p63s23p63d5,则该元素在周期表中位于( )
A.ⅤB族 B.ⅢB族
C.Ⅷ族 D.ⅤA族
知识点二 核外电子排布与周期表的分区及性质特点
按照核外电子排布,可把元素周期表分成5个区。除ds区外,各区的名称来自按构造原理最后填入电子的能级符号,其性质特点如下

元素周期表中的对角线规则
在元素周期表中,某些主族元素与其右下方的另一主族元素的某些性质是相似的,这称为对角线规则。常见的是下表中对角线上的元素:

具体地讲:
(1)锂和镁的相似性
①锂与镁的沸点较为接近:
元素 | Li | Na | Be | Mg |
沸点/℃ | 1341 | 881.4 | 2467 | 1100 |
②锂和镁在氧气中燃烧分别生成对应的氧化物:
4Li+O2点燃(=====)2Li2O,2Mg+O2点燃(=====)2MgO。
③锂和镁与水的反应都比钠与水的反应缓慢,并且生成的氢氧化物都难溶于水,覆盖在金属表面阻碍反应的继续进行。
④碱金属中只有锂在室温下能与氮气反应生成Li3N,同样镁也能与氮气发生反应生成Mg3N2。
⑤在碱金属的氟化物、碳酸盐和磷酸盐中,锂盐是难溶于水的,相应的镁盐也难溶于水。
(2)铍和铝的相似性
①铍和铝都可与酸、碱反应放出氢气,并且铍在浓硝酸中也发生钝化。
②BeO和Al2O3都是两性氧化物:BeO+2HCl===BeCl2+H2O,BeO+2KOH===K2BeO2+H2O;BeO、Al2O3硬度大、熔点高;Be(OH)2和Al(OH)3都是两性氢氧化物。
③BeCl2和AlCl3都是共价化合物,易升华。
④可溶性的铍、铝盐易水解:Be2++2H2OBe(OH)2+2H+,Al3++3H2OAl(OH)3+3H+。
1.下列有关元素周期系的叙述正确的是( )
A.元素周期系中第ⅠA族元素又称为碱金属元素
B.元素周期系中每一周期元素的种类均相等
C.元素周期系的形成原因是核外电子排布的周期性变化
D.每一周期的元素最外层电子数均是1→8,周而复始
2.某化学学习小组在学习元素周期表和周期的划分时提出了以下观点:①周期表的形成是由原子的结构决定的;②元素周期表中第ⅠA族元素统称为碱金属元素;③每一周期的元素原子外围电子排布均是从ns1开始至ns2np6结束;④元素周期表的每一周期元素的种类均相等;⑤基态原子核外电子排布式为1s22s22p3和1s22s22p63s23p3的两元素位于同一周期;⑥一般周期序数越大,该周期所含金属元素越多。你认为正确的是( )
A.①⑥ B.①②③⑤⑥
C.①④⑥ D.②③⑤
3.根据下列基态原子的最外层电子排布,能确定该元素在元素周期表中位置的是( )
A.4s1 B. 3sn
C.nsnnp3n D.ns2np3
未完,有需要的朋友,私信免费送哦。有需要提高成绩的,也可以私信联系我哦