学习建议
高考中选修3的考试题型变化不大,常考“原子结构与元素的性质(基态微粒的电子排布式、电离能及电负性的比较)、元素周期律;分子结构与性质(化学键类型、原子的杂化方式、分子空间构型的分析与判断);晶体结构与性质(晶体类型、性质及与粒子间作用的关系、以晶胞为单位的密度、微粒间距与微粒质量的关系计算及化学式分析等)”这些内容,可以在做完选择题之后,优先选择这道题,考试用时不超10分钟,平时限时训练也给自己这样的要求。
原子核外电子排布原理
1.能层、能级与原子轨道
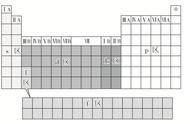
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。这种电子云轮廓图称为原子轨道。

【特别提示】
(1)任一能层的能级总是从s能级开始,而且能级数等于该能层序数。
(2)以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。(3)构造原理中存在着能级交错现象。由于能级交错,3d轨道的能量比4s轨道的能量高,排电子时先排4s轨道再排3d轨道,而失电子时,却先失4s轨道上的电子。
(4)前四周期的能级排布(1s、2s、2p、3s、3p、4s、3d、4p)。第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
(5)当出现d轨道时,虽然电子按ns,(n-1)d,np顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前。
(6)在书写简化的电子排布式时,并不是所有的都是[X]+价电子排布式(注:X代表上一周期稀有气体元素符号)。
2.基态原子的核外电子排布
(1)能量最低原理
电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图。

注意:所有电子排布规则都需要满足能量最低原理。
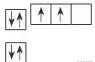
(2)泡利原理
每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
(3)洪特规则
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。
3.基态、激发态及光谱示意图