物质的结构与性质命题热点
①核外电子排布规律;
②书写原子或离子核外电子排布式、电子排布图(即轨道表示式);
③第一电离能、电负性的变化规律及其应用;
④物质中化学键类型的判断;
⑤分子中的原子轨道杂化类型及分子的空间构型的判断;
⑥分子间作用力、氢键及分子的性质;
⑦常见四种晶体的判断方法及性质;
⑧金属晶体的堆积模型;
⑨均摊法求解晶体化学式;
⑩常见晶体结构分析;
⑪有关晶胞的计算。
一、原子结构与性质

解题方法与技巧
(1)核外电子排布式:用数字在能级符号右上角表明该能级上排布的电子数。例如,K:1s22s22p63s23p64s1。为了简化,通常把内层已达稀有气体电子结构的部分称为“原子实”,用该稀有气体的元素符号加方括号来表示。例如,K:[Ar]4s1。
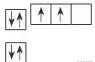
(2)核外电子排布图:用□表示原子轨道,↑和↓分别表示两种不同自旋方向的电子。如氧原子的核外电子排布图可表示为

。核外电子排布图能直观地反映出原子的核外电子的自旋情况以及成对电子对数和未成对的单电子数。
(3)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
(4)构造原理是书写基态原子的电子排布式的依据,也是绘制基态原子的电子排布图的主要依据之一。
基态原子的核外电子排布的表示方法(以硫原子为例)