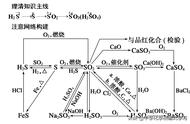
高中三年的化学方程式总结如下:
金属氧化物
1、低价态的还原性:
6FeO O2===2Fe3O4
FeO 4HNO3===Fe(NO3)3 NO2 2H2O
FeO 4H NO3―=Fe3 NO2↑ 2H2O
2、氧化性:
Na2O2 2Na2Na2O(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al.
Fe2O3 3H22Fe 3H2O(制还原铁粉)
Fe3O4 4H23Fe 4H2OCuO H2Cu H2O
2Fe3O4 16HI==6FeI2 8H2O 2I2
2Fe3O4 16H 4I―=6Fe2 8H2O 2I2
Fe2O3 Fe3FeO(炼钢过程中加入废钢作氧化剂)
FeO CFe CO(高温炼钢调节C含量)
2FeO Si2Fe SiO2(高温炼钢调节Si含量)
3、与水的作用:
Na2O H2O==2NaOH
Na2O H2O=2Na 2OH–
2Na2O2 2H2O===4NaOH O2↑
2Na2O2 2H2O=4Na 4OH– O2↑
(此反应分两步:Na2O2 2H2O===2NaOH H2O2;2H2O2===2H2O O2H2O2的制备可利用类似的反应:BaO2 H2SO4(稀)===BaSO4 H2O2)
MgO H2O===Mg(OH)2(缓慢反应)
4、与酸性物质的作用:
Na2O SO3==Na2SO4Na2O CO2==Na2CO3MgO SO3===MgSO4
Na2O 2HCl==2NaCl H2O
Na2O 2H =2Na H2O
2Na2O2 2CO2==2Na2CO3 O2↑
Na2O2 H2SO4(冷,稀)===Na2SO4 H2O2
MgO H2SO4===MgSO4 H2O
MgO 2H =Mg2 H2O
Al2O3 3H2SO4===Al2(SO4)3 3H2O
Al2O3 6H =2Al3 3H2O
Al2O3 2NaOH===2NaAlO2 H2O(Al2O3两性氧化物)
Al2O3 2OH―=2AlO2― H2O
FeO 2HCl===FeCl2 H2O
FeO 2H =Fe2 H2O
Fe2O3 6HCl===2FeCl3 3H2O
Fe??2O3 6H =2Fe3 3H2O
Fe3O4 8HCl===FeCl2 2FeCl3 4H2O
Fe3O4 8H =2Fe3 Fe2 4H2O
含氧酸
1、氧化性:
4HClO3 3H2S===3H2SO4 4HCl
ClO3– 3H2S=6H SO42– Cl–
HClO3 HI===HIO3 HCl
ClO3– I–=IO3– Cl–
3HClO HI===HIO3 3HCl
3HClO I-=IO3– 3H Cl–
HClO H2SO3===H2SO4 HCl
HClO H2SO3=3H SO42– Cl–
HClO H2O2===HCl H2O O2↑
HClO H2O2=H Cl– H2O O2↑
(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)
2H2SO4(浓) CCO2↑ 2SO2↑ 2H2O
2H2SO4(浓) S3SO2↑ 2H2O
H2SO4 Fe(Al)室温下钝化6H2SO4(浓) 2FeFe2(SO4)3 3SO2↑ 6H2O
2H2SO4(浓) CuCuSO4 SO2↑ 2H2O
H2SO4(浓) 2HBr===SO2↑ Br2 2H2O(不能用浓硫酸与NaBr制取HBr)
H2SO4(浓) 2HI===SO2↑ I2 2H2O(不能用浓硫酸与NaI制取HI)
H2SO4(稀) Fe===FeSO4 H2↑
2H Fe=Fe2 H2↑
H2SO3 2H2S===3S↓ 3H2O
4HNO3(浓) CCO2↑ 4NO2↑ 2H2O
6HNO3(浓) SH2SO4 6NO2↑ 2H2O
5HNO3(浓) PH3PO4 5NO2↑ H2O
5HNO3(稀) 3P 2H2O3H3PO4 5NO↑
5H 5NO3- 3P 2H2O3H3PO4 5NO↑
6HNO3(浓足) Fe===Fe(NO3)3 3NO2↑ 3H2O
4HNO3(浓) Fe(足)===Fe(NO3)2 NO2↑ 2H2O(先得Fe3 ,在Fe过量时再生成Fe2 的盐)
4HNO3(稀足) Fe===Fe(NO3)3 NO↑ 2H2O
4H NO3- Fe=Fe3 NO↑ 2H2O
30HNO3 8Fe===8Fe(NO3)3 3N2O↑ 15H2O
30H 6NO3– 8Fe=8Fe3 3N2O↑ 15H2O
36HNO3 10Fe===10Fe(NO3)3 3N2↑ 18H2O
36H 6NO3– 10Fe=8Fe3 3N2↑ 18H2O
30HNO3 8Fe===8Fe(NO3)3 3NH4NO3 9H2O
30H 3NO3– 8Fe=8Fe3 3NH4 9H2O
4Zn 10HNO3(稀)==4Zn(NO3)2 N2O↑ 5H2O
4Zn 10H 2NO3–=4Zn2 N2O↑ 5H2O
4Zn 10HNO3(稀)==4Zn(NO3)2 NH4NO3 3H2O
4Zn 10H NO3–=4Zn2 NH4 5H2O
2、还原性:
H2SO3 X2 H2O===H2SO4 2HX(X表示Cl2,Br2,I2)
H2SO3 X2 H2O=4H SO42- X–
2H2SO3 O2==2H2SO4
2H2SO3 O2=4H SO42-
H2SO3 H2O2===H2SO4 H2O
H2SO3 H2O2=2H SO42– H2O
5H2SO3 2KMnO4===2MnSO4 K2SO4 2H2SO4 3H2O
5H2SO3 2MnO4–=2Mn2 4H 3SO42– 3H2O
H2SO3 2FeCl3 H2O===H2SO4 2FeCl2 2HCl
H2SO3 2Fe3 H2O=4H 2Fe2 SO42–
3、酸性:
H2SO4(浓) CaF2CaSO4 2HF↑(不挥发性酸制取挥发性酸)
H2SO4(浓) NaClNaHSO4 HCl↑(不挥发性酸制取挥发性酸)
H2SO4(浓) 2NaClNa2SO4 2HCl↑(不挥发性酸制取挥发性酸)
H2SO4(浓) NaNO3NaHSO4 HNO3↑(不挥发性酸制取挥发性酸)
3H2SO4(浓) Ca3(PO4)23CaSO4 2H3PO4(强酸制弱酸酸)
2H2SO4(浓) Ca3(PO4)22CaSO4 Ca(H2PO4)2(工业制磷肥)
3HNO3 Ag3PO4==H3PO4 3AgNO3
3H Ag3PO4=H3PO4 3Ag
2HNO3 CaCO3==Ca(NO3)2 H2O CO2↑
2H CaCO3=Ca2 H2O CO2↑
(用HNO3和浓H2SO4不能制备H2S,HI,HBr,SO2等还原性气体)
4H3PO4 Ca3(PO4)23Ca(H2PO4)2(重钙)
H3PO4(浓) NaBrNaH2PO4 HBr↑(不挥发性酸制取挥发性酸,磷酸是非氧化性酸)
H3PO4(浓) NaINaH2PO4 HI↑
4、不稳定性:
2HClO2HCl O2↑(保存在棕色瓶中)
4HNO34NO2↑ O2↑ 2H2O(保存在棕色瓶中)
H2SO3H2O SO2↑(在加热或酸性条件下分解)
H2CO3H2O CO2↑(在加热或酸性条件下分解)
H4SiO4H2SiO3 H2OH2SiO3SiO2↓ H2O
H2S2O3H2O S↓ SO2↑(在加热或酸性条件下分解)
碱
1、低价态的还原性:
4Fe(OH)2 O2 2H2O===4Fe(OH)3
2、与酸性物质的作用:
2NaOH SO2(少量)==Na2SO3 H2O
OH– SO2=SO32– H2O
NaOH SO2(足)==NaHSO3
OH- SO2(足)=HSO3–
2NaOH SiO2==Na2SiO3 H2O
OH- SiO2=SiO32– H2O
2NaOH Al2O3==2NaAlO2 H2O
2OH- Al2O3=2AlO2– H2O
2KOH Cl2==KCl KClO H2O
Cl2 2OH–=Cl– ClO– H2O
NaOH HCl==NaCl H2O
H OH=H2O
NaOH H2S(足)==NaHS H2O
OH– H2S=HS– H2O
2NaOH H2S(少量)==Na2S 2H2O
2OH– H2S=S2– 2H2O
3NaOH AlCl3==Al(OH)3↓ 3NaCl
3OH– Al3 =Al(OH)3↓
NaOH Al(OH)3==NaAlO2 2H2O(AlCl3和Al(OH)3哪个酸性强?)
OH– Al(OH)3=AlO2– 2H2O
Ca(OH)2 2NH4Cl2CaCl2 2NH3↑ 2H2O(实验室制NH3)
NaOH NH4ClNaCl NH3↑ H2O
Mg(OH)2 2NH4Cl==MgCl2 2NH3??H2O(Al(OH)3 NH4Cl不溶解)
Ba(OH)2 H2SO4==BaSO4↓ 2H2O
2H 2OH– Ba2 SO42–=BaSO4↓2H2O
3、不稳定性:
Mg(OH)2MgO H2O2Al(OH)3Al2O3 3H2O
2Fe(OH)3Fe2O3 3H2OCu(OH)2CuO H2O2AgOH==Ag2O H2O
水解反应方程式
1、单水解---可逆水解
NH4Cl H2ONH3??H2O HClNH4 H2OH NH3??H2O
FeCl3 3H2OFe(OH)3 3HClFe3 3H2OFe(OH)3 3H
AlCl3 3H2OAl(OH)3 3HClAl3 3H2OAl(OH)3 3H
CuSO4 2H2OCu(OH)2 H2SO4(金属活动顺序表中Mg2 以后的阳离子均水解)
NaHCO3 H2OH2CO3 NaOH(NaHSO4不水解,NaHSO3电离大于水解)
Na2CO3 H2ONaHCO3 NaOHCO32- H2OHCO3- OH–
NaHCO3 H2OH2CO3 NaOH(第一步远远大于第二步,二步不能叠加)
Na2SO3 H2ONaHSO3 NaOHSO32- H2OHSO3- OH–
NaHSO3 H2OH2SO3 NaOH(第一步远远大于第二步,二步不能叠加)
HSO3- H2OH2SO3 OH-
Na2S H2ONaHS NaOHS2- H2OHS- OH–
NaHS H2OH2S NaOH(第一步远远大于第二步,二步不能叠加)
HS- H2OH2S OH-
Na3PO4 H2ONa2HPO4 NaOHPO43- H2OHPO42- OH–
Na2HPO4 H2ONaH2PO4 NaOHHPO42- H2OH2PO4- OH–
NaH2PO4 H2OH3PO4 NaOHH2PO4- H2OH3PO4 OH–
CH3COONa H2OCH3COOH NaOHCH3COO- H2OCH3COOH OH–
C6H5ONa H2OC6H5OH NaOHC6H5O- H2OC6H5OH OH–
2、双水解
CH3COONH4 H2OCH3COOH NH3??H2O
NH4F H2OHF NH3??H2O
Al2S3 6H2O==Al(OH)3↓ H2S↑(隔绝空气,密封保存)
Mg3N2 6H2O==Mg(OH)2↓ NH3↑(隔绝空气,密封保存)
Na3P 3H2O==3NaOH PH3↑(隔绝空气,密封保存)
Zn3P2 6H2O==Zn(OH)2↓ PH3↑(Zn3P2一种老鼠药,PH3剧毒神经毒剂)
CaC2 2H2O==Ca(OH)3↓ C2H2↑(隔绝空气,密封保存)
C2H5ONa H2O==C2H5OH NaOH
电解及电极方程式
1、电解质溶液在惰性电极条件下,或阴极是较活泼金属电极,阳极是惰性电极条件下的电解
2NaCl 2H2O2NaOH H2↑ Cl2↑
(-)2H2O 2e-==H2↑ 2OH-或2H 2e-==H2↑
( )2Cl--2e-==Cl2↑
2Cl- 2H2O2OH- H2↑ Cl2↑
CuCl2Cu Cl2↑
(-)Cu2 2e-==Cu↓
( )2Cl--2e-==Cl2↑
Cu2 2Cl-Cu↓ Cl2↑
2CuSO4 2H2O2Cu↓ O2↑ 2H2SO4
(-)2Cu2 4e-==2Cu↓
( )2H2O-4e-==O2↑ 4H 或:4OH--4e-==O2↑ 2H2O4H2O4H 4OH-
2Cu2 2H2O2Cu↓ O2↑ 4H
2H2O2H2↑ O2↑
(-)4H 4e-==2H2↑
( )4OH--4e-==O2↑ 2H2O
中性电解4H2O4H 4OH-
2H2OH2↑ O2↑
酸性水解:
(-)4H 4e-==2H2↑
( )2H2O-4e-==O2↑ 4H 4OH--4e-==O2↑ 2H2O
2H2OH2↑ O2↑
碱性水解:
(-)4H2O 4e-==2H2↑ 4OH-或:4H 4e-==2H2↑
2、电镀:镀件作阴极,被镀金属作阳极,被镀金属的含氧酸盐作电解质溶液
镀铜:CuSO4电镀液
镀件(-)Cu2 2e-==Cu↓
纯铜( )Cu–2e-==Cu2
镀锌:ZnSO4电镀液
镀件(-)Zn2 2e-==Zn↓
纯锌( )Zn–2e-==Zn2
镀银:AgNO3电镀液
镀件(-)Ag e-==Ag↓
纯银( )Ag–e-==Ag
镀镍:NiSO4电镀液
镀件(-)Ni2 2e-==Ni↓
纯镍( )Ni–2e-==Ni2
3、熔融状态下的电解:
2NaCl(熔融)2Na Cl2↑
(-)2Na 2e-==2Na
( )2Cl--4e-==Cl2↑
2Na 2Cl-(熔融)2Na Cl2↑
2Al2O3(熔融)4Al 2O2↑
(-)4Al3 12e–==4Al
( )6O2--12e-==3O2↑
4Al3 6O2-4Al 3O2↑
NaHF2(熔融)H2↑ F2↑
(-)2H 2e–==H2↑
( )2F--2e-==F2↑
2HFH2↑ F2↑
盐
1、氧化性:(在水溶液中)
2FeCl3 Fe==3FeCl22Fe3 Fe=3Fe2
2FeCl3 Cu===2FeCl2 CuCl2(用于雕刻铜线路版)2Fe3 Cu=2Fe2 Cu2
2FeCl3 Zn(少量)===2FeCl2 ZnCl22Fe3 Zn=2Fe2 Zn2
FeCl3 Ag===FeCl2 AgCl↓2Fe3 Cl- 2Ag=2Fe2 2AgCl↓
Fe2(SO4)3 2Ag===FeSO4 Ag2SO4↓(较难反应)Fe(NO3)3 Ag不反应
2FeCl3 H2S===2FeCl2 2HCl S↓2Fe3 H2S=2Fe2 2H S↓
2FeCl3 2KI===2FeCl2 2KCl I22Fe3 2I-=2Fe2 I2
FeCl2 Mg===Fe MgCl2Fe2 Mg=Fe Mg2
NaNO2 NH4Cl==NaCl N2↑ 2H2O(实验室制氮气)NH4 NO2-=N2↑ 2H2O
2、还原性:
2FeCl2 3Cl2===2FeCl3(在水溶液中不需加热)
2Fe2 3Cl2=2Fe3 6Cl-
3Na2S 8HNO3(稀)===6NaNO3 2NO↑ 3S 4H2O
3S2- 8H 2NO3-=2NO↑ 3S 4H2O
3Na2SO3 2HNO3(稀)===3Na2SO4 2NO↑ H2O
3SO32- 2H 2NO3-=3SO42- 2NO↑ H2O
2Na2SO3 O2===2Na2SO4(Na2SO3在空气中易变质)
Na2SO3 SNa2S2O3
Na2S Cl2==2NaCl S↓(在水溶液中)S2- Cl2=2Cl- S↓
3、与碱性物质的作用:
Ca(OH)2 CuSO4==Cu(OH)2↓ CaSO4↓(波尔多液)
MgCl2 2NH3??H2O===Mg(OH)2↓ 2NH4Cl
Mg2 2NH3??H2O=Mg(OH)2↓ 2NH4
AlCl3 3NH3??H2O===Al(OH)3↓ 3NH4Cl
Al3 3NH3??H2O=Al(OH)2↓ 3NH4
FeCl3 3NH3??H2O===Fe(OH)3↓ 3NH4Cl
Fe3 3NH3??H2O=Fe(OH)3↓ 3NH4
CuSO4 2NH3??H2O(不足)==Cu(OH)2↓ (NH4)2SO4
Cu2 2NH3??H2O=Cu(OH)2↓ 2NH4
Cu(OH)2 4NH3??H2O=Cu(NH3)4(OH)2 4H2O
Cu(OH)2 4NH3??H2O=[Cu(NH3)4]2 2OH- 4H2O铜氨溶液
CuSO4 4NH3??H2O(足)==Cu(NH3)4SO4 4H2O总方程式
Cu2 4NH3??H2O=[Cu(NH3)4]2 4H2O铜氨溶液
AgNO3 NH3??H2O==AgOH↓ NH4NO32AgOH=Ag2O(灰黑色) H2O
Ag2O 4NH3??H2O=2[Ag(NH3)2] 2OH- 3H2O银氨溶液
AgNO3 2NH3??H2O==Ag(NH3)2NO3 2H2O
Ag 2NH3??H2O=[Ag(NH3)2] 2H2O总方程式
ZnSO4 2NH3??H2O(不足)==Zn(OH)2↓ (NH4)2SO4
Zn2 2NH3??H2O=Zn(OH)2↓ 2NH4
Zn(OH)2 4NH3??H2O=Zn(NH3)4(OH)2 4H2O
ZnSO4 4NH3??H2O(足)==Zn(NH3)4SO4 4H2O
Zn2 4NH3??H2O=[Zn(NH3)4]2 4H2O总方程式
4、与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸
Na3PO4 2HCl===Na2HPO4 2NaClPO43- 2H =H2PO4-
Na2HPO4 HCl===NaH2PO4 NaClHPO42- H =H2PO4-
NaH2PO4 HCl===H3PO4 NaClH2PO4- H =H3PO4
Na2CO3 HCl===NaHCO3 NaClCO32- H =HCO3-
NaHCO3 HCl===NaCl H2O CO2↑HCO3- H =CO2↑ H2O
3Na2CO3 2AlCl3 3H2O==2Al(OH)3↓ 3CO2↑ 6NaCl(物质之间的双水解反应)
3CO32- 2Al3 3H2O=2Al(OH)3↓ 3CO2↑
3Na2CO3 2FeCl3 3H2O===2Fe(OH)3↓ 3CO2 6NaCl(物质之间的双水解反应)
3CO32- 2Fe3 3H2O=2Fe(OH)3↓ 3CO2↑
3NaHCO3 AlCl3===Al(OH)3↓ 3CO2↑(物质之间的双水解反应)
3HCO3- Al3 =2Al(OH)3↓ 3CO2↑
3NaHCO3 FeCl3===Fe(OH)3↓ 3CO2↑(物质之间的双水解反应)
3HCO3- Fe3 =2Fe(OH)3↓ 3CO2↑
3Na2S Al2(SO4)3 6H2O===2Al(OH)3↓ 3H2S↑(物质之间的双水解反应)
3S2- 2Al3 3H2O=2Al(OH)3↓ 3H2S↑
3NaAlO2 AlCl3 6H2O==4Al(OH)3↓ 3NaCl(物质之间的双水解反应)
3AlO2- Al3 6H2O=4Al(OH)3↓
3NaAlO2 FeCl3 6H2O==3Al(OH)3↓ Fe(OH)3↓ 3NaCl
3AlO2- Fe3 6H2O=3Al(OH)3↓ Fe(OH)3↓
NaAlO2 NH4Cl 2H2O==Al(OH)3↓ NH3??H2O NaCl
AlO2- NH4 2H2O=Al(OH)3↓ NH3??H2O
Na2CO3 H2O CO2===2NaHCO3
CO32- H2O CO2=2HCO3-
Na2CO3 H2O 2SO2==2NaHSO3 CO2↑(1:2)
CO32- H2O 2SO2=2HSO3- CO2↑
2Na2CO3(足) H2O SO2==Na2SO3 2NaHCO3(CO2中的SO2不能用Na2CO3洗气)
2CO32- H2O SO2=SO32- 2HCO3-(2:1)
Na2CO3 SO2==Na2SO3 CO2(1:1)
CO32- SO2=SO32- CO2
NaHCO3 SO2===NaHSO3 CO2(CO2中的SO2可能用NaHCO3洗气)
2HCO3- SO2=2HSO3- CO2
2NaHCO3 SO2==Na2SO3 2CO2 H2O
2HCO3- SO2=SO32- 2CO2 H2O
Na2SiO3 2HCl===H2SiO3↓ NaCl或Na2SiO3 2HCl H2O===H4SiO4↓ 2NaCl
SiO32- 2H =H2SiO3↓或SiO32- 2H H2O=H4SiO4↓
Na2SiO3 CO2 2H2O===H2SiO3↓ Na2CO3
SiO32- CO2 2H2O=H4SiO4↓ CO32-
5、盐与盐复分解反应
Na2SO4 BaCl2==BaSO4↓ 2NaCl(沉淀不溶于盐酸、硝酸)
SO32- Ba2 =BaSO4↓
Na2SO3 BaCl2==BaSO3↓ 2NaCl(沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消失)
SO32- Ba2 =BaSO3↓
Na2CO3 BaCl2==BaCO3↓ 2NaCl(沉淀溶于盐酸、沉淀消失)
CO32- Ba2 =BaCO3↓
Na2CO3 CaCl2==CaCO3↓ 2NaCl(NaHCO3不反应)
CO32- Ca2 =CaCO3↓
AgNO3 NaCl==AgCl↓ NaNO3Ag Cl-=AgCl↓
AgNO3 NaBr==AgBr↓ NaNO3Ag Br-=AgBr↓
AgNO3 KI==AgCl↓ KNO3Ag I-=AgI↓
3AgNO3 Na3PO4==Ag3PO4↓ 3NaNO33Ag PO43-=Ag3PO4↓
CuSO4 Na2S==CuS↓ Na2SO4Cu2 S2-=CuS↓
FeCl3 3KSCN==Fe(SCN)3 3KCl
Fe3 3SCN-=Fe(SCN)3(血红色,用于Fe3 的特性检验)
6、不稳定性:
Na2S2O3 H2SO4===Na2SO4 S↓ SO2↑ H2O
S2O32- 2H =S↓ SO2↑ H2O
NH4ClNH3↑ HCl↑
NH4INH3↑ HI↑2HIH2 I2
NH4INH3↑ H2↑ I2↑
NH4HCO3NH3↑ H2O CO2↑
2KNO32KNO2 O2↑
2Cu(NO3)32CuO 4NO2↑ O2↑
2AgNO32Ag 2NO2↑ O2↑(保存在棕色瓶中)
5NH4NO34N2↑ 2HNO3 9H2O
10NH4NO38N2↑ 4NO2↑ O2↑ 20H2O↑(硝酸铵爆炸反应)
2KMnO4K2MnO4 MnO2 O2↑
2KClO32KCl 3O2↑
2NaHCO3Na2CO3 H2O CO2↑
Ca(HCO3)2CaCO3 H2O CO2↑
CaCO3CaO CO2↑MgCO3MgO CO2↑
电离方程式
1、酸的电离(H2SO4、HNO3、HCl、HBr、HI、H3PO4、HF、H2SO3、CH3COOH、H2CO3、H2S、HNO2、C6H5OH、HCN、HClO)
H2SO4==2H SO42-或:H2SO4 2H2O==2H3O SO42-
HNO3==H NO3-或:HNO3 H2O==H3O NO3-(以下雷同)
HCl==H Cl
HBr==H Br
HI==H I
H3PO4H H2POH2POH HPOHPOH PO
HFH F
H2SO3H HSOHSOH SO
CH3COOHH CH3COO
H2CO3H H
H2SH H
HNO2H NOC6H5OHH C6H5O-(苯酚不是酸,显酸性)
HCNH CN
HClOH ClO
H2OH OH
2H2OH3O OH
2、碱的电离(NaOH、KOH、Ba(OH)2、Mg(OH)2、Al(OH)3、NH3??H2O)
NaOH==Na OHKOH==K OHBa(OH)2==Ba2 2OH
Mg(OH)2Mg2 2OH
Al(OH)3Al3 3OH酸式电离:Al(OH)3H H2O
NH3??H2O 2OH
Ca(OH)2==Ca2 2OH(澄清石灰水)
Ca(OH)2Ca2 2OH(石灰悬浊液)
3、盐的电离(NaCl、Na2SO4、NaHSO4、Na2SO3、NaHSO3、MgSO4、CaSO4、Al2(SO4)3、CuSO4、AlCl3、AgNO3、CH3COONa、NH4NO3、FeCl3、Na2CO3、NaHCO3、Na2S、NaHS、NaH2PO4、Na2HPO4、Na3PO4、KI、NaBr、NaClO、AgCl、CaCO3)
NaCl==Na Cl
Na2SO4==2Na
NaHSO4==H Na
Na2SO3==2Na
NaHSO3==Na HSO3-(错误书写:NaHSO3==Na H SO42-)
MgSO4==Mg2
Al2(SO4)3==2Al3 3
CuSO4==Cu2
AlCl3==Al3 3Cl
AgNO3==Ag NO3
CH3COONa==CH3COO Na
NH4NO3==NH4 NO3-
FeCl3==Fe3 3Cl
Na2CO3==2Na
NaHCO3==Na (错误书写:NaHCO3==Na H )
Na2S==2Na
NaHS==Na HS(错误书写:NaHS==Na H )
NaH2PO4==Na H2PO
Na2HPO4==2Na HPO(错误书写:Na2HPO4==2Na H PO)
Na3PO4==3Na PO
KI==K I―NaBr==Na Br―NaClO==Na ClO―
AgClAg (难溶、微溶物质在水中发生微弱电离)
CaCO3Ca2 (错误书写:CaCO3==Ca2 CO)
CaSO4Ca2 SO(错误书写:CaSO4==Ca2 SO)
3、熔融电离
NaClNa MgCl2Mg2 2
Na2O2Na O2―Al2O32Al3 3O2―
,