常见的酸和碱的物理性质和化学性质要熟练记忆,熟记常见的酸和碱的各种化学反应,以及各种化学反应的类型。
第七单元 常见的酸和碱
第一节 几种常见的酸 碱
一、酸的性质
1、盐酸和硫酸的物理学性质(浓)
(1)盐酸(物理)
无色、透明有刺激性气味的液体,密度比水大,打开浓盐酸瓶塞,瓶口出现白雾,说明浓盐酸具有挥发性,工业盐酸因具有杂质而略显黄色。

(2)、硫酸(物理性质)
①无色、粘稠油状的液体,密度比水大,具有吸水性,因此可用作某些气体的干燥剂。
②稀释浓硫酸:把浓硫酸沿玻璃棒慢慢引流到水里,切不可将水注入浓硫酸。

2、盐酸和硫酸的化学性质(稀)
因为盐酸和硫酸在溶液中都能电离出氢离子,所以化学性质相似。
(1) 酸与指示剂的作用
酸能使紫色的石蕊变成红色,使无色酚酞不变色,使蓝色石蕊试纸变成红色
(2)酸 金属——盐 氢气
A、化学方程式
Mg 2HCl=MgCl2 H2↑
Fe 2HCl=FeCl2 H2↑现象:铁的表面有气泡产生,溶液有无色变成浅绿色
Zn 2HCl= ZnCl2 H2↑
2Al 6HCl=2AlCl3 3H2↑
Mg H2SO4=MgSO4 H2↑
Fe H2SO4=FeSO4 H2↑现象:铁的表面有气泡产生,溶液有无色变成浅绿色
Zn H2SO4= ZnSO4 H2↑
2Al 3H2SO4=Al2(SO4)3 3H2↑
B、金属活动性顺序表的应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①只有排在氢前面的金属才能与酸发生反应
②酸能常为稀盐酸、稀硫酸,浓酸不行
③K、 Ca、 Na除外
C、用途:验室制氢气
(3)、酸 金属氧化物——盐 水
①化学方程式
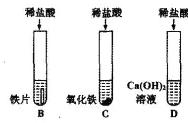
Fe2O3 6HCl=2FeCl3 3H2O 现象:铁锈消失,溶液有无色变为黄色
Fe2O3 3H2SO4=Fe2(SO4)3 3H2O现象:铁锈消失,溶液有无色变为黄色
②用途:金属除锈
(4)、酸 碱——盐 水
①Al(OH)3 3HCl =AlCl3 3H2O 治疗胃酸过多
②Mg(OH)2 H2SO4=MgSO4 2H2O 治疗胃酸过多
③Ca(OH)2 2HCl=CaCl2 2H2O
④Ca(OH)2 H2SO4=CaSO4 2H2O
⑤NaOH HCl=NaCl H2O
(5)、酸 盐——另一种酸 另一种盐
①化学方程式
2HCl Na2CO3=2NaCl H2O CO2↑用于检验碳酸根离子
HCl AgNO3=AgCl↓ HNO3用于检验氯离子
H2SO4 BaCl2=BaSO4↓ 2HCl用于检验硫酸根离子
②实例:检验一瓶无色溶液中含有碳酸根离子
取无色溶液少许注入试管,向试管中加入稀盐酸,将产生的气体通入澄清石灰水,如果石灰水变浑浊,证明产生二氧化碳,因此证明原溶液中含有碳酸根。

二、碱的性质
1、氢氧化钙和氢氧化钠
(1)、氢氧化钠(物理性质)
俗称:火碱、烧碱、苛性钠
白色固体,易溶液于水,溶于水后放出大量的热,溶液有涩味和滑腻感,放在空气中溶易吸收水分而潮解,具有强腐蚀性。
(2)、氢氧化钙(物理性质)
俗称:熟石灰、消石灰
制法:CaO H2O=Ca(OH)2 (放出大量的热)
白色固体,微溶液于水。
2、氢氧化钙和氢氧化钠的化学性质
因为氢氧化钙和氢氧化钠在溶液中都能电离出氢氧离子,所以化学性质相似。
(1)、碱与指示剂的作用
碱能使紫色的石蕊变成蓝色,使无色酚酞变红色,使红色石蕊试纸变成蓝色
(2)、碱 非金属氧化物——盐 水
①化学方程式
CO2 Ca(OH)2=CaCO3↓ H2O 检验二氧化碳
CO2 2NaOH=Na2CO3 H2O
SO2 2NaOH= Na2SO3 H2O 工业除去二氧化硫
SO3 2NaOH= Na2SO4 H2O
②氢氧化钠为什么必须密封保存
因为氢氧化钠容易吸收空气中的水分而潮解,还容易跟空气中的二氧化碳反应而变质。

(3)、碱 酸——盐 水
A、化学方程式
①Al(OH)3 3HCl =AlCl3 3H2O
②Mg(OH)2 H2SO4=MgSO4 2H2O
③Ca(OH)2 2HCl=CaCl2 2H2O
④Ca(OH)2 H2SO4=CaSO4 2H2O
⑤NaOH HCl=NaCl H2O
B、中和反应:酸和碱作用生成盐和水的反应
C、判断反应是否发生:根据反应现象。 例如:在①②中,氢氧化铝和氢氧化镁白色固体消失,则证明反应进行。在③④⑤中,反应物氢氧化钠、氢氧化钙、硫酸和盐酸均为无色,反应生成物氯化钙、硫酸钙和氯化钠也为无色,所以无法根据现象判断,必须借助指示剂。
D、用途:①治疗胃酸过多②中和酸性的土壤

(4)、碱 盐——另一种碱 另一种盐
Ca(OH)2 Na2CO3= CaCO3↓ 2NaOH 工业制氢氧化钠
Ca(OH)2 CuSO4=Cu(OH)2↓ CaSO4现象:产生蓝色沉淀
2NaOH CuSO4= Cu(OH)2↓ Na2 SO4现象:产生蓝色沉淀
3NaOH FeCl3=Fe(OH)3↓ 3NaCl现象:产生红褐色沉淀
(5)、复分解反应
①定义:两种化合物在溶液中互相交换成分,生成另外两种化合物的反应。中和反应是复分解反应中的一种。
②复分解反应发生的条件:生成沉淀、气体、水
,