×100%=50%,故d正确;
考点:金属的物理性质及用途;金属的化学性质;金属锈蚀的条件及其防护;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
16.(1)Mg H2SO4 === MgSO4 H2↑或2Al 3H2SO4 === Al2(SO4)3 3H2↑;(2)过滤、漏斗;(3)Mg(OH)2 2HCl==MgCl2 2H2O;(4)分解反应;(5)铝在空气中与氧气反应,其表面形成一层致密的氧化物薄膜,从而阻止铝进一步氧化。
【解析】
试题分析:根据生产流程 (1)步骤一中的反应方程式为:Mg H2SO4 === MgSO4 H2↑或2Al 3H2SO4 === Al2(SO4)3 3H2↑;(2)步骤二中的分离操作名称为过滤;因为是固液分离;需用到的玻璃仪器有玻璃棒、烧杯、漏斗等;(3)步骤三的化学方程式为Mg(OH)2 2HCl==MgCl2 2H2O;(4)步骤四的基本类型为分解反应;(5)铝具有很好的抗腐蚀性能的原因是:铝在空气中与氧气反应,其表面形成一层致密的氧化物薄膜,从而阻止铝进一步氧化。
考点:金属资源的回收利用 、化学方程式的书写、反应类型的判断
17.(1)导电性、延性、延展性等
(2)比较黄铜(或合金)和铜(或纯金属)的硬度
【解析】
试题分析:(1)性质决定用途,用途反映性质,故铜用于做导线,是利用金属的导电性、延性、延展性
(2)两块金属片相互刻画后,在纯铜片上有明现的划痕。该实验探究的目的是:比较黄铜(或合金)和铜(或纯金属)的硬度
考点:金属的性质,合金的性质
18. (1)高锰酸钾是紫黑色粉末不是黑色粉末;(2)蓝色;(3)根据实验②不是铁粉,首先排除聊高锰酸钾,只剩余碳和氧化铜粉末;(4)红色;浑浊;C 2CuO 高温 2Cu CO2↑
【解析】
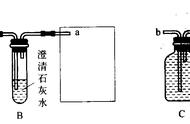
试题分析:⑴ 分析:小燕同学认为一定不是高锰酸钾,原因是高锰酸钾是紫黑色粉末不是黑色粉末;(2)根据实验结论可知氧化铜与硫酸反应生成硫酸铜溶液,铜离子在溶液中显蓝色;⑶ 反思:小华同学认为不做实验①,运用逻辑推理的方法也能得出其中之一是氧化铜的结论,原因是根据实验②不是铁粉,首先排除聊高锰酸钾,只剩余碳和氧化铜粉末;⑷ 实验二:他们又进行了如下实验:将两种黑色粉末混合加热(实验装置如下图),发现黑色粉末逐渐变红色,澄清石灰水变浑浊,种黑色粉末发生反应的化学方程式C 2CuO 高温 2Cu CO2↑
考点: 物质的推断及转化
19.(1)C (2)铬原子的相对原子质量为52.00 (3)防止铁生锈 (4) 3
【解析】
试题分析:(1)牛奶和鸡蛋清富含的营养素是蛋白质。
(2)从元素周期表中的相关元素的内容中解读以下内容:原子序数=质子数=核电花数=原子的核外电子数=24;其元素符号为Cr;其元素名称为铬;其元素种类为金属元素;相对原子质量为52.00等。
(3)因铬在空气中表面能生成抗腐蚀性的致密氧化膜,可用于隔绝铁与空气中的氧气和水蒸气,防止铁生锈。
(4)在化合物中各元素正负化合价的代数和为零。Cr2(SO4)中硫酸根显-2价,可列式为:铬元素的化合价×2 (-2)×3=0 铬元素的化合价= 3。
考点:食物中的有机物、元素周期表的意义、金属的锈蚀与防护、化合价的计算
20.(1)4CO Fe3O4 高温 3Fe 4CO2 (2)分子不同,化学性质不同
(3)加入稀盐酸,看是否有气泡产生
【解析】
试题分析:这是一个框图式的推断题,找到题目的"题眼",包括特殊的物质,特殊的反应、特殊的现象、特殊的反应条件及常见的三角关系等,此题的"题眼"是,D为单质,且B、D中含有地壳中含量第二的金属元素,故可判断单质D为Fe,而B自然是四氧化三铁,这样不难推出A为CO,C为CO2
(1)A为CO,B是四氧化三铁,故A和B反应的化学方程式为:4CO Fe3O4 高温 3Fe 4CO2
(2)A为CO, C为CO2,两者化学性质不同的原因:分子不同,化学性质不同
(3)B是四氧化三铁,D为Fe,区分两者的简单方法:加入稀盐酸,看是否有气泡产生,有气泡产生的是铁,反之为四氧化三铁
考点:框图式的推断题
21.(1)过滤;(2)防止局部温度过高,液滴飞溅(使液体受热均匀);
(3)Fe、Cu ;Fe CuSO4 == FeSO4 Cu ; Fe H2SO4 == FeSO4 H2↑
【解析】
试题分析: (1)操作a得到固体和液体,故操作a为过滤;(2)操作b为蒸发结晶,玻璃棒的作用是防止局部温度过高,液滴飞溅(使液体受热均匀);(3)由流程图可知,A为铁,铁能置换出硫酸铜溶液中的铜,故固体的成分中含有铜和铁,Fe、Cu;加入过量A时反应的化学方程式:Fe CuSO4 == FeSO4 Cu ;要除去铜中的铁得到硫酸亚铁,最好加入B为稀硫酸,反应的化学方程式:Fe H2SO4 == FeSO4 H2↑。
考点: 流程图;金属的性质
22.(1)催化作用 (2)③Fe2O3 6HCl===2FeCl3 3H2O ④3CO Fe2O3高温2Fe 3CO2
(3)涂油或刷漆、电镀等 (4)光合作用
【解析】
试题分析:这是一个框图式的推断题,找到题目的"题眼",包括特殊的物质,特殊的反应、特殊的现象、特殊的反应条件及常见的三角关系等,此题的"题眼"是A为固体氧化物,且A为黑色粉末,同时通过反应分析,A在前后都出现,意味着是催化剂,故A为二氧化锰,B、D是由相同元素组成的无色液体,且B具有消毒*菌作用,可判断B为过氧化氢溶液,D自然为水,那C为氧气,X是最常见的金属,又同时与氧气、水作用,说明是一个生锈的过程,E为固体氧化物,可判断即为铁锈的主要成分氧化铁,Y、Z为无色气体,其中Y有毒,即为一氧化碳,则Z自然为二氧化碳,黄色溶液F自然为氯化铁溶液
(1) 反应①中A物质是二氧化锰,作用是: 催化作用
(2) 反应③的方程式:Fe2O3 6HCl===2FeCl3 3H2O,反应④的化学方程式:3CO Fe2O3高温2Fe 3CO2
(3)反应②就是铁生锈,在日常生活中为防止反应②的发生,可采取的措施是:涂油或刷漆、电镀等
(4)反应⑤是二氧化碳和水反应,但生成有机物,故名称为光合作用
考点:框图式的推断题,特殊物质的颜色、反应等
23.(1)Zn H2SO4 = ZnSO4 H2↑ (2) C、B、A (3) 防止液体局部受热而飞溅
(4)Ag Cu(NO3)2 (5)0.4g
【解析】
试题分析:(1)根据金属的活动性顺序,三种金属Zn、Cu、Ag,只有锌能与稀硫酸反应,所以步骤①中发生反应的化学方程式:Zn H2SO4 = ZnSO4 H2↑,从而可以判断金属C为锌
(2)根据步骤②,在金属Cu、Ag化合物中,加入A的硝酸盐,结果置换出了金属A,所以可判断B为铜,A自然为银,故A、B、C三种金属的活动性顺序是C>B>A
(3)操作b是从溶液中结晶得到固体,故为蒸发,其中用到玻璃棒的作用是:搅拌,防止液体局部受热而飞溅
(4)根据上面的分析件数A为银,化学式为:Ag,B的硝酸盐是通过铜和硝酸银溶液反应得到,故为硝酸铜,化学式为:Cu(NO3)2
(5)根据化学反应方程式:Zn H2SO4 = ZnSO4 H2↑中锌与氢气的质量关系,即可求出氢气的质量
解:设氢气的质量为x
Zn H2SO4 = ZnSO4 H2↑
2
13g x
65:2=13g:x
X=0.4g
考点:金属的活动性,根据化学方程式计算,蒸发操作
,