在反应中,若氧化作用和还原作用发生在同一分子内部中处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。
歧化反应是化学反应的一种,一般需要在酸性或碱性的反应环境中更容易进行。反应中某个元素的化合价既有上升又有下降,与归中反应相对。
绝大部分非金属单质都处在中间价态的位置,因而有可能发生歧化反应。在中学阶段能发生歧化反应的单质只有卤素(Cl2、Br2、I2)、S和P。
一、常见的歧化反应
⒈ 氯气与水在常温下反应
Cl2 H2O=HClO HCl
此反应中Cl2原本是0价,反应后一个升为 1价,一个降为-1价。
⒉ 氯气与氢氧化钠溶液反应
⑴ 常温下反应:
氯气与氢氧化钠溶液在常温下反应,生成氯化钠、次氯酸钠和水。
化学方程式:
Cl2 2NaOH=NaCl NaClO H2O
其离子方程式为:
Cl2 2OH-=Cl- ClO- H2O
氯气中氯元素的化合价为0。反应后氯化钠中氯的化合价下降到-1价;而次氯酸钠中氯的化合价则上升到 1价。
⑵ 高温下反应
氯气和氢氧化钠溶液在高温下反应,生成氯酸钠、氯化钠和水。
离子方程式为:
3Cl2 6OH-=ClO3- 5Cl- 3H2O
这两个反应都是典型的歧化反应。
⑶ 与其它卤素反应
Br2、I2都可与氢氧化钠溶液在常温下反应,生成卤化钠、次卤酸钠和水。
化学方程式:
X2 2NaOH=NaX NaXO H2O
离子方程式为:
X2 2OH-=X- XO- H2O

⒊漂白粉(Ca(ClO)2)的反应
⑴ 与少量盐酸反应
将少量盐酸加入漂白粉溶液时,能生成有漂白作用的HClO;但加入的盐酸过多时,会生成黄绿色气体(Cl2)。氯气有剧毒,因而使用漂白粉溶液时一定要避免混入强酸(家用洁厕剂等)。离子方程式为:
2H ClO- Cl-=Cl2↑ 2H2O
⑵ 与二氧化碳反应
一般情况下空气中的少量CO2便可使漂白粉发挥漂白作用,此时Ca(ClO)2与空气中的CO2作用生成有强氧化性的HClO。
将CO2气体通入漂白粉溶液,产生白色沉淀。
其离子方程式为:
Ca2 2ClO- CO2 H2O=CaCO3↓ 2HClO
⑶ 与二氧化硫反应
Ca(ClO)2 有很强的氧化性,若将SO2气体通入漂白粉溶液,反应将生成CaSO4而不是CaSO3。
⒋ 过氧化钠与二氧化碳的反应
过氧化钠吸收二氧化碳生成碳酸钠和氧气。
2Na2O2 2CO2=2Na2CO3 O2↑
Na2O2的氧元素化合价为-1,而Na2CO3的氧元素为-2价,O2中氧元素化合价为0 ,因此过氧化钠中的氧元素化合价既有升高的,也有降低的,这样的反应就叫歧化反应。
⒌ 氯酸钾的反应
在KClO3中,一部分氯( 5价)被氧化为氯( 7价)(KClO4);另一部分被还原为氯( 4价)(ClO2)。
3KClO3=KClO4 2ClO2 H2O
发生歧化反应的原因是由于该元素具有高低不同的氧化态,可以在适宜的条件下同时向较高和较低的氧化态转化。

⒍ S、P单质与碱的反应
3S 6OH-=2S2- SO32- 3H2O
P4 3OH- 3H2O=PH3↑ 3H2PO2-
要注意两个反应的不同之处在于在水溶液中S2-离子稳定而P3-离子不稳定,后者会与水反应生成PH3气体,PH3气体剧毒且易自燃,因而切忌将白磷与碱液混合!
⒎ 醛与碱溶液的反应
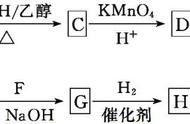
没有α-氢原子的醛在强碱(浓)的作用下发生分子间氧化还原反应生成羧酸和醇,一分子醛被氧化成羧酸,另一分子醛被还原成醇。如:
2C(CH3)3-CHO NaOH→C(CH3)3-CH2OH C(CH3)3-COONa
⑴ 甲醛与氢氧化钠溶液反应
2HCHO NaOH→CH3OH HCOONa
⑵ 甲醛与氢氧化钾溶液反应
苯甲醛在氢氧化钾溶液中部分氧化为苯甲酸钾;部分还原为苯甲醇,也是歧化反应:
2C6H5CHO KOH─→C6H5COOK C6H5CH2OH
⒏ 甲苯歧化
甲苯在催化剂(一般采用硅铝催化剂)作用下,使一个甲苯分子中的甲基转移到另一个甲苯分子上而生成一个苯分子和一个二甲苯分子,这种反应称作歧化反应。一个甲苯与一个三甲苯也可发生歧化反应(亦称烷基转移反应)生成两个二甲苯分子。工业上用这个方法生产用途广泛的苯和二甲苯。

二、其它歧化反应
以上基本上是高中阶段接触的歧化反应,下面还有几种在考题中出现过的能发生歧化反应的物质:
⒈ 硫代硫酸钠与酸反应
Na2S2O3溶液与酸反应:
2H S2O32-=S↓ SO2↑ H2O
反应现象:生成淡黄色沉淀,放出无色有刺激性气味的气体。
Na2S2O3溶液是分析化学中常用的“碘量法”的实验试剂,进行碘量实验时一定要将pH控制在接近中性范围,溶液偏酸性会使Na2S2O3分解失效,偏碱性时会使加入的I2发生歧化反应3I2 6OH-=IO3- 5I- 3H2O而失效。
碘量实验的反应式为
I2 2S2O32-=2I- S4O62-。
⒉ 氧化亚铜在酸性条件下反应
Cu2O(氧化亚铜)1价的Cu(Cu )在酸性条件下易发生歧化反应,生成Cu单质和2价的Cu2 离子:
Cu2O 2H =Cu Cu2 H2O
反应现象:溶液逐渐变蓝。
⒊ K2MnO4(锰酸钾)制取KMnO4
K2MnO4(锰酸钾)2008年全国高考题中提到的KMnO4的制取方法,便应用了K2MnO4的歧化反应,下面简要说明实验室中用MnO2制取KMnO4的方法:
⑴ 将氢氧化钾、二氧化锰和氯酸钾固体混合共热至熔融,制得绿色的锰酸钾晶体
2MnO2 KClO3 6KOH=3K2MnO4 KCl 3H2O
⑵ 调节pH至弱碱性使K2MnO4发生歧化反应,将生成的MnO2沉淀过滤,浓缩溶液后即可得到KMnO4晶体。
3MnO42- 2H2O=2MnO4- MnO2↓ 4H