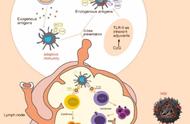
2013年西非埃博拉疫情的指示病例是住在几内亚Meliandou村的一名18个月大男孩
既然上述这几种疫苗都能激发出足够多的中和抗体,是否意味着它们可以被批准上市了呢?答案是否定的。抗体的出现只能说明人体免疫系统对疫苗起了反应,但这种反应是否足以保护接种者免受病毒的攻击?这种保护的有效率到底是多少?可以维持多长时间?以上这几个关键问题光凭Ⅱ期临床是无法知道的,因为真实环境中的病毒很可能通过一些我们不知道的办法躲过抗体的阻挠。
有些时候,抗体的存在甚至是有害的,反而会加重病情,这一现象被称为“抗体依赖增强效应”(Antibody-dependent Enhancement,简称ADE)。这个效应是在1966年进行的一次合胞病毒(Syncytial Virus)疫苗人体试验过程中首次被发现的,前期临床试验表明合胞病毒疫苗确实能诱导出抗体,但Ⅲ期临床试验却导致一大批受试者病情加重,两名儿童因此死亡。
十多年后进行的一次登革热疫苗临床试验再次出现了这种情况,说明这个ADE效应不是偶然的,而是一种相当普遍的现象。科学家们经过仔细研究,发现登革热病毒有4种亚型,如果你对其中某一种亚型产生了抗体,但却又感染了另一种亚型的病毒,后者就会在前一种抗体的帮助下加速入侵人体的进程,导致更加严重的病情。
已知人类冠状病毒有7个亚型,除了几乎已经消失的SARS和目前尚未扩散开来的MERS之外,还有4种亚型能够导致普通的感冒,所以很多人体内应该已经有了针对某种冠状病毒的抗体。事实上,已有研究表明,在从未感染过新冠病毒的群体当中,有三分之一到一半的人体内能够检测到针对新冠病毒的免疫反应,原因很可能就是另外4种普通感冒病毒所导致的。但这样的免疫反应到底是会保护我们免受新冠病毒的困扰,还是会诱导出ADE,从而导致我们病得更加厉害呢?这个问题仅凭前期临床试验是无法解答的,必须进行更大规模的Ⅲ期临床试验才能找到答案。
话虽如此,前期临床试验测出的一些关于疫苗的基本免疫学指标还是很有用的,除了可以帮助科学家们确定Ⅲ期临床的接种剂量之外,还可以帮助疫苗研发者们对新冠疫苗的可行性做出合理的预判,从而决定是否值得继续做下去。
比如,目前已经完成Ⅱ期临床的新冠疫苗都能诱导出中和抗体,这是件大好事。要知道,并不是所有病毒都能诱导出抗体的,HIV病毒就是一例,所以艾滋病疫苗一直没能研发出来。普通感冒病毒往往也无法诱导出足够强的保护性抗体,这是因为大部分轻型感冒病毒都止步于上呼吸道,而人体免疫系统对于上呼吸道感染往往不怎么重视,不会诱导出强烈的免疫反应,否则的话我们就会天天生病了。
前段时间有媒体报道说,新冠病毒诱导出的中和抗体滴度在病愈3个月后便急剧下降,甚至低到检测不出来了,这个消息让很多读者感到绝望,认为即使将来研制出了新冠疫苗,最多也只能保3个月。但是,来自主流研究机构的顶尖免疫学家们纷纷站出来辟谣,指出病人痊愈后抗体水平急剧下降是正常现象,不值得大惊小怪。
原来,当病人痊愈后,大部分负责分泌抗体的B细胞都会死亡,所以抗体水平的下降是正常的。但是,会有一小部分B细胞转移进骨髓里,以“骨髓浆细胞”的形式潜伏下来。这些细胞虽然不再大量分泌抗体了,但它们仍然处于一种随时待命的状态,一旦再次遇到相同的外来抗原,它们就能迅速投入战斗,在短时间内生产出大量具有针对性的抗体,因此这些细胞又被称为“记忆细胞”,它们是“抗体免疫”的主力部队,也是疫苗之所以会有效的主要原因。
退一步讲,即使“抗体免疫”失效了,我们还可以依靠“细胞免疫”来保护自己,这项工作主要是由T细胞来完成的。T细胞种类繁多,功能也远比B细胞复杂得多。两种免疫细胞之间的互动更加复杂,甚至连一般的免疫学家也很难说得清楚。普通人只需记住两点就行了,那就是T细胞最主要的功能是找出并*死感染了病毒的人体细胞,而B细胞的主要功能是分泌抗体,防止病毒入侵。
如果用军事术语来做个比喻的话,我们可以将B细胞(及其分泌的抗体)看成是负责“扫街”的巡逻兵,需要直接和入侵敌军正面作战。而T细胞则相当于特种部队,最擅长挨家挨户搞搜查,把已经入侵成功并潜伏下来的敌人抓出来。我们当然希望在敌人潜入民居之前就将其抓获,所以由B细胞主导的“抗体免疫”的预防效果最好。但如果T细胞很厉害,能够把所有已被入侵的人体细胞都抓出来并消灭掉,我们也能满意。因此,起码从理论上讲,无论是“抗体免疫”还是“细胞免疫”都能起到保护作用。甚至有研究表明,由T细胞主导的“细胞免疫”的记忆力要比由B细胞主导的“抗体免疫”更加持久。比如,今年距离“非典”已经过去了17年,大部分曾经感染过SARS的病人体内早已检测不到“非典”抗体了,但科学家在他们身上仍然发现了能够识别SARS表面抗原的T细胞,这些细胞仍然保留了那次“非典”感染留下的记忆。
虽然T细胞非常重要,但T细胞的研究难度要比抗体大得多,需要在专门的实验室里进行,耗时也更长,所以此前大部分疫苗研发工作都围绕着抗体来进行。但随着细胞研究技术的不断进步,越来越多的免疫学家开始关注T细胞免疫了。这次“新冠疫苗六杰”的前期临床试验全都检测了T细胞,结果发现受试疫苗都能激发出足够强的“细胞免疫”反应,这就进一步增强了疫苗研发者们的信心。
至于说此前媒体报道的新冠病人二次感染的问题,目前只有两例是被病毒测序结果所证实的,应该说并不是普遍现象。根据世卫组织所做的统计,目前全世界的新冠确诊病例数已经超过了2700万,出现个把异常情况是很正常的,各位读者不必过分担心。
大家最应该关注的是病毒的基因突变,因为突变有可能会导致现有的疫苗失效。新冠病毒是一种单链RNA病毒,包含29903个碱基(字母)。RNA病毒的突变率通常会比较高,但瑞士巴塞尔大学(University of Basel)的分子流行病学家艾玛·霍德克罗夫特(Emma Hodcroft)博士通过研究后发现,新冠病毒自带一个基因复制纠错机制,使得这种病毒每个月只积累两个单碱基突变,突变率大约是流感病毒的一半,HIV病毒的四分之一。
相比于突变率,更为重要的是编码刺突蛋白的那部分基因是否发生了显著的变化,因为刺突蛋白是绝大多数新型疫苗的靶点。目前最值得警惕的是D614G突变,该突变导致刺突蛋白上的一个天冬氨酸变成了甘氨酸。携带这一突变的新冠病毒是在1月末时首次被发现的,基因分析表明它很可能源自中国。此后这一突变所占份额越来越大,目前已经成为新发疫情的主流,说明它很可能具备更强的传染性。所幸科学家们发现这一突变的位置并不在刺突蛋白的抗原结合部内,应该不会影响现有疫苗的效果,但未来会不会有新的突变就不好说了。大家只能希望新冠病毒的基因变异不要来得太快,否则就得换个新的疫苗。
总之,新冠疫苗的前期临床表现还算是中规中矩,没有出现太多反常规的地方,看来疫苗大概率能够研发出来,只是时间早晚的问题了,而决定疫苗上市时间的关键就是Ⅲ期临床试验是否顺利。

2013年,德国汉堡伯恩哈德·诺希特热带医学研究所的工作人员在研究埃博拉病毒
Ⅲ期临床
所有的前期临床都是在严格控制的实验室条件下进行的,医生们清楚地知道自己在做什么,志愿者们也都知道自己接种的是哪类疫苗,可能会出现什么样的后果。但是,由于人体的代谢过程极为复杂,再加上安慰剂效应的存在,光凭实验室研究不足以证明疫苗安全有效,必须在真实的生活环境中进行大规模双盲对照试验才能得出肯定的结论,Ⅲ期临床试验就是为了这个目的而存在的。
以新冠疫苗为例,Ⅲ期临床至少需要招募数万名不同年龄、不同性别、不同身体状况的志愿者,先通过新冠抗体测试确保他们从来没有感染过新冠病毒,再将他们随机分成两组,一组按照Ⅱ期临床总结出来的最佳剂量接种受试疫苗,另一组则接种安慰剂。之后让这些志愿者回到自己的家中照常生活,但定期需要回到医院进行检查,看看这两组志愿者的新冠感染率是否有差别。
从这个流程来看,疫苗的Ⅲ期临床有两个难点需要克服:第一,试验地点必须具备良好的医疗基础设施,医护人员的水平也必须满足一定的要求,否则很难对这么多志愿者进行严格的监督和随访,最后得出的数据质量也不会令人满意。事实上,最近几年出现的新传染病大都是在非洲和西亚的一些发展中国家暴发的,当地医疗机构的水平达不到要求,只能从外面派医疗队去主持临床试验,难度非常大,这就是新疫苗迟迟无法通过Ⅲ期临床检验的最大原因。
第二,只有当对照组积累了一定的感染数之后,疫苗的Ⅲ期临床才能宣告结束,否则数据是没法用的。举例来说,假如某临床试验对照组1万人当中只有几个人感染,那么即使疫苗组无人感染,也说明不了什么问题,因为这个差别很可能是随机发生的,不能证明疫苗确实有效。但假如对照组1万人当中有数百人感染,疫苗组只有几个人感染,那就很能说明问题了。
要想在短时间内满足这一要求,疫苗所针对的传染病必须流行到一定程度才行。艾滋病疫苗之所以研发不出来,一个重要原因就是越来越普及的性卫生教育大大降低了HIV的感染率,导致艾滋病疫苗的Ⅲ期临床时间越拖越长,所需的接种人数越来越多,制药企业承受不起了。
当年“非典”疫苗的研发之所以被提前终止,也是因为隔离政策迅速控制住了疫情,科学家们根本找不到合适的人群进行Ⅲ期临床试验。此次新冠疫苗的Ⅲ期临床试验如果没有巴西和美国等疫情失控的国家存在的话,也是很难进行下去的,尤其是基础医疗设施相对健全的巴西更是成为各大疫苗研发公司的最爱。“新冠疫苗六杰”当中,科兴中维、牛津大学和德国BioNTech这3家均选择了巴西作为Ⅲ期临床的主要试验点,另外两家中国公司国药和康希诺则分别选择了同样疫情严重而基础设施相对完好的阿联酋和俄罗斯,莫德纳公司的Ⅲ期临床将在美国进行,牛津和BioNTech也把一部分Ⅲ期临床选在了美国,这几家公司都在赌美国在短时间内控制不住疫情。
虽然这几个国家看似疫情严重,但因为人口基数大,具体到每个人来说,被新冠病毒感染的可能性也是不高的,研发者很可能需要等待很长的时间才能积累到一定的病例数,这就是为什么大部分疫苗专家都预言新冠疫苗不太可能在今年年底前被批准。
举例来说,假设一种新冠疫苗的Ⅲ期临床招募了1.5万~2万志愿者,再假设这些人生活在一个年感染率为1%的地区(随着社交距离政策的广泛实施,如今这样的地区即使在美国和巴西也很难找到了),还要假设疫苗具有50%的有效率,那么半年之后研究人员将会发现大约150例确诊病例,勉强可以满足Ⅲ期临床的最低要求。
换句话说,即使一切顺利的话,普通民众最快也需要等到明年年初才能打上第一针新冠疫苗。
正是在这种情况下,有人提出可以招募一批志愿者充当“敢死队”,主动感染新冠病毒,以此来加快疫苗的研发进程。这个想法看似激进,其实在疫苗研发早期已经尝试过很多次了。当初詹纳第一次试验天花疫苗时就是拿自家园丁的8岁儿子做的试验,不过那是200多年前发生的事情,现在医疗界对伦理问题管得很严,不可能随便拿活人来做试验了。但新冠有几点比较特殊,一来这种病毒的致死率并不高,尤其是对于身体健康的中青年人来说,致死率远低于0.1%,如果只挑选这样的志愿者来参加试验,似乎还是可以接受的。二来新冠疫情对整个社会的影响太大了,哪怕早一天研发出疫苗,都能带来巨大的社会效益和经济效益,所以肯定有人愿意报名,研发者不愁招不到志愿者。牛津大学的疫苗研发团队就曾公开招募志愿者进行所谓的“人体挑战试验”(Human Challenge Trials),据说有3万人报了名。
虽然民间支持者众多,但还是有不少学者对这一做法表示了异议。美国哥伦比亚大学的病毒学家安吉拉·拉斯姆森(Angela Rasmussen)就认为,任何人体试验都必须把所有可能出现的情况如实告诉志愿者,这才是符合伦理道德的做法。但新冠是一种全新的传染病,后果难以预料,万一感染者出现了某种我们不知道的后遗症,或者疫苗诱发了前文提到过的“抗体依赖增强效应”,导致原本身体健康的年轻志愿者病情加重,研发团队是没办法交代的。另外,如果参加试验的都是身体健康的年轻人,那就无法知道这种疫苗对于身体虚弱的中老年人是否同样有效。再加上试验条件下的病毒感染剂量和感染方式很可能和真实情况有所不同,其结果就更说明不了问题了。
由于上述原因,“人体挑战试验”的作用很可能极其有限,最多只能作为一种辅助手段,弄不好反而会浪费宝贵的医疗资源。所以拉斯姆森认为我们不能把希望寄托在“人体挑战试验”上,还是得老老实实按部就班地进行真实情况下的Ⅲ期临床试验,这个时间是我们必须付出的代价。
疫苗批准太快还有一个坏处,那就是我们将无法知道疫苗的有效性到底能维持多久。如果一款疫苗只能为接种者提供3个月的保护期,每隔3个月都必须补打一针,那将严重影响全民免疫计划的实施。
目前已上市的预防性疫苗的有效期差别非常大,像麻疹和腮腺炎疫苗打一针可以管一辈子,但流感疫苗仅能维持一个流感季,这是什么原因呢?研究发现,人体免疫系统的记忆力在一般情况下都是非常强的,影响疫苗有效期的主要因素是病原体发生了变异,像流感和艾滋病都是如此。另一个原因是感染的严重程度不足,导致免疫系统虽然记住了病原体的样子,但却没有足够的动力发动有效的攻击,像普通感冒这样只影响上呼吸道的轻型传染病就很难引起免疫系统的重视,不会分泌足够多的抗体去应对它们,新冠的无症状感染者很可能就属于这种情况。
有一个理论认为,像水痘病毒和疱疹病毒等病原体在环境中非常常见,我们的免疫系统很可能在我们不知情的情况下不断地被它们强化,所以水痘和疱疹疫苗的有效期非常长。但破伤风病毒不太常见,我们的免疫系统很难再次遇到它,所以破伤风疫苗的有效期只有几年,过了一段时间就失效了。新冠病毒是一种全新的病毒,我们并不知道新冠疫苗属于上述哪一种情况,只能通过临床试验来发现真相。
还有一点十分重要,那就是疫苗的潜在副作用只能通过大规模长时间的临床试验才能看出来。事实上,“新冠疫苗六杰”当中开展Ⅲ期临床时间最早、接种人数最多的牛津疫苗刚刚在9月8日宣布暂停试验,理由是发现了一位接种者出现了严重的不良反应。类似情况在7月12日就曾经出现过一次,一位妇女在接种后出现了类似横贯性脊髓炎(Transverse Myelitis)的症状,好在研究人员很快判定这位妇女得的是多发性硬化症(Multiple Sclerosis),和疫苗无关,试验得以继续进行。新出现的这次不良反应的具体细节尚未透露,很可能也与横贯性脊髓炎有关。这是一种神经系统炎症,是病毒性疫苗常见的一种不良反应,此前在狂犬病、黄热病和禽流感疫苗临床试验时都曾经发生过,不算什么特别罕见的事情。科学家们所要做的就是首先判断这位患者接种的到底是疫苗还是安慰剂,如果是后者万事大吉,如果是前者,那就必须委托第三方独立机构进行详细的调查,才能知道此事到底是不是和疫苗有关。整个调查过程很可能需要花费数周的时间才能完成,大家只能耐心等待。
总之,疫苗的Ⅲ期临床试验绝不能省,否则监管机构很难放心让健康人使用。迄今为止只有一款炭疽疫苗未经完整的Ⅲ期临床检验就获得了美国FDA的紧急批准,但那是为了应对可能出现的恐怖袭击。新冠疫苗不存在这个问题,没有理由弯道超车。所以,虽然来自特朗普政府的政治压力非常大,但美国FDA还是坚持了原则,于2020年6月30日公布了新冠疫苗的审批流程指南,规定第一款疫苗必须通过Ⅲ期临床试验的检验,证明其有效率在50%以上才能被FDA批准上市。这个标准和流感疫苗差不多,获得了绝大部分科学家的认可。
不过,随着美国总统大选日期日益临近,来自特朗普的压力越来越大,美国FDA真不一定能扛得住。好在参与疫苗研发的9家疫苗厂商于9月8日共同签署了一项承诺,保证“按照高道德标准和合理的科学原则开发和测试用于新冠病毒的潜在疫苗”。
这些厂商能否顶得住来自政治和经济上的压力,信守自己的诺言?我们只能拭目以待了。
科学之外
以上讲的都是疫苗的科学问题,但科学之外的问题更棘手。最近这半个世纪出现的新传染病之所以缺乏疫苗,大部分原因都和科学无关。
疫苗研发最主要的问题就是缺钱,因为大部分新传染病都来自发展中国家,当地政府没钱搞疫苗研发,即使研发出来老百姓也买不起,所以新疫苗的市场前景堪忧。再加上很多新发传染病疫情通过早期隔离和药物治疗等措施往往就能被控制住,使得疫苗产业的投资风险非常高,“非典”就是个好例子。别看当年的“非典”来势汹汹,可疫情只持续了半年多就被控制住了,研究机构连疫苗都还没有研制成功呢,更别说临床试验了。
于是,几乎所有的私营制药企业都只关心富裕国家的儿童疫苗,以及少量专供军队和国际旅行者使用的特殊疫苗,对来自发展中国家的新型传染病不感兴趣。这种现状和科学无关,而是当今社会贫富差距过大,国家和地区之间经济发展水平不均衡所导致的必然结果,仅靠自由市场经济杠杆是解决不了这个问题的,必须由国际机构或非政府组织牵头,联合慈善机构的慷慨捐赠才有可能解决,埃博拉疫苗就是一个很好的案例。
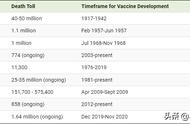
埃博拉病毒最早是1976年在刚果民主共和国(当时还叫扎伊尔)境内被发现的,它会导致感染者全身大出血,至今无药可医。据世卫组织统计,1976~2012年间全世界一共发生过24次规模不等的埃博拉疫情,加起来一共有2387个确诊病例,1590人死亡,死亡率高达67%。如此厉害的传染病却一直没有研发出疫苗,这是因为埃博拉病毒通过患者体液(包括血液、精液和排泄物等)扩散,不像新冠那样能够通过空气传播给没有身体接触的人,控制起来相对容易一些,所以迄今为止绝大部分病例都局限在撒哈拉以南的非洲,其他地方极其罕见,因此也就没人愿意投资研发埃博拉疫苗,只能等到每次疫情暴发之后再通过隔离来应对。
上世纪90年代,美国耶鲁大学的约翰·罗斯(John Rose)博士将一种在家畜身上发现的水疱性口炎病毒(VSV)改造成了疫苗载体,从此科学家们只要知道了病毒的基因序列,就可以很容易地制造出针对它的疫苗。罗斯博士将这个疫苗载体免费提供给了超过100家实验室,这就相当于为全世界的疫苗研发者提供了一个万能的疫苗平台,大大简化了新疫苗的研发程序。这些实验室在这个平台上尝试了禽流感、麻疹、“非典”和寨卡病毒等传染病疫苗,均取得了阶段性的成功,前文提到的腺病毒载体也是这一技术的变种。此事充分说明科研专利应该只限于商业链条的末端,对于前期的理论研究来说,知识共享才是最有价值的做法。
德国马堡大学的海因茨·菲尔德曼(Heinz Feldmann)博士用罗斯开发的这套系统制造出了世界上第一款埃博拉疫苗,但他既没有钱也没有动力去做人体试验,便将自己的研究成果存放在大学实验室的冰箱里。1999年,加拿大政府拨款成立了国家微生物实验室,菲尔德曼受聘担任了特殊病原体研究小组的组长。他把埃博拉疫苗带到了加拿大,利用实验室提供的先进科研设备进行了动物实验,并在此基础上制成了一批可以在人身上使用的埃博拉疫苗。
值得一提的是,为了做实验,菲尔德曼一直在四处找钱,但均遭到拒绝,最后还是加拿大国防部以预防恐怖袭击为理由拨给了他200万美元,这才让这项研究得以继续下去。
2008年,菲尔德曼离开了加拿大,加里·科宾格(Gary Kobinger)接管了埃博拉项目。但这项研究已处于半停滞状态,因为没人愿意继续给钱了。如果没有2013年的那次全球疫情大暴发,这个埃博拉疫苗很可能至今仍然存放在加拿大实验室的冰箱里。
2013年12月,几内亚暴发了新的埃博拉疫情,病毒第一次从乡村进入了城市,并借助频繁的人员流动迅速扩散到了利比里亚和塞拉利昂。眼看疫情即将失控,世卫组织于2014年8月8日将疫情升级为全球公共卫生紧急事件,并向全世界公开招标,希望有人能投资研发埃博拉疫苗。葛兰素史克(GSK)和默克制药公司(Merck)响应了号召,后者出钱买下了加拿大埃博拉疫苗的使用权,并在维康信托基金会(Wellcome Trust)的帮助下,开始在疫情最严重的西非展开Ⅲ期临床试验。
因为这个病的致死率太高,如果像往常那样从社会上招募志愿者,并且只给对照组用安慰剂的话就太不人道了。为了加快研发速度,同时又能阻止疫情扩散,默克公司采用了“圆圈接种法”(Ring Vaccination),即只要任何地方出现新疫情,防疫人员便立刻赶过去,以疫情暴发原点为中心,为周围所有可能被感染的人群进行接种,希望能把病毒的传播路径封死。圆圈里的易感人群被随机地分成两组,一组立即接种,另一组延迟21天后再接种,这么做既可以测试出疫苗是否有效,又不至于导致接种安慰剂的对照组大量生病,更加符合人道主义精神。
与此同时,传统的隔离法也起到了效果,疫情迅速被控制住了,导致默克的Ⅲ期临床试验差点因为缺乏病例而没能完成。最终只有几内亚的Ⅲ期临床试验得出了疫苗有效的结论,并于2016年底发表了论文,塞拉利昂和利比里亚进行的临床试验都因为招募不到足够多的志愿者而没有做完。因为这个原因,很多人对这款疫苗的有效性持保留意见,所以这个被命名为Ervebo的埃博拉疫苗并没有立即得到批准。
2013年开始于西非的那次疫情是迄今为止最严重的埃博拉疫情,病毒在两年半的时间里一共导致28616人被感染,11310人死亡。Ervebo疫苗虽然没有派上大用场,但如此惨烈的现实终于让国际社会意识到了疫苗的重要性。当埃博拉疫情再次于2018年8月在刚果暴发后,国际组织立即开始为灾区民众接种Ervebo疫苗。可惜因为疫情暴发地区正好在打内战,接种人员一共遭到了42次袭击,导致85人伤亡。勇敢的医护人员克服了种种困难,还是为30.3万人进行了接种。最终这场疫情一共感染了3470人,导致其中的2287人死亡,是有史以来第二严重的埃博拉疫情。但因为有疫苗的帮助,无论是感染人数还是死亡人数均远小于2013年的那次西非疫情。
因为在实战中表现良好,欧盟委员会终于在2019年11月11日正式批准了默克的Ervebo疫苗。美国FDA紧随其后,也于2019年12月19日批准了这款疫苗,使之成为第一款被国际社会广泛承认的埃博拉疫苗。专注于为发展中国家提供疫苗的非政府组织“全球疫苗免疫联盟”(GAVI)于2019年底宣布将采购50万剂Ervebo疫苗,以应对未来可能出现的新疫情。
虽然有非政府组织和慈善机构的资助,默克制药公司在埃博拉疫苗项目上肯定还是亏钱的。为了弥补他们的损失,美国FDA为默克公司提供了一张“打折券”,可以在未来某个时候使用FDA的新药审批快速通道。这个“打折券”制度是FDA为了鼓励制药企业投资新传染病疫苗研发而设立的,可以让这些药企在其他那些能赚钱的药物上得到补偿。这种“打折券”甚至可以买卖,可惜因为最近几年FDA发放了太多的“打折券”,其市场价从最高峰时的每张3.5亿美元降到了目前的每张1亿美元左右。2019年底,一家制药公司刚刚以9500万美元的价格卖掉了一张“打折券”,不过他们没有披露买家的名字。
作为全世界首个针对新传染病的预防性疫苗,埃博拉疫苗的研发过程极具参考价值。在这个故事里,我们可以看到科学家们的坚韧不拔、政府部门的高瞻远瞩、慈善机构的无私奉献和私人企业的趋利本能是如何互相影响并相互激励的,只有当这些强大却又分散的力量联合起来,在尊重科学的基础上相互合作,人类才能早日摆脱传染病的纠缠,过上健康的生活。
这方面的另一个例子是由中国军事科学院军事医学研究院和康希诺疫苗团队研发的一款埃博拉疫苗。这款疫苗用的是和新冠疫苗几乎一样的技术,早在2017年10月19日就在中国获批了,但因为研发过程没有完全按照国际标准来进行,所以没有获得国际社会的广泛认可,没能拿到国外的订单,因此也就无法在下一个疫情来临时很快派上用场。
在这个全球化盛行的时代,各种传染病利用全球化提供的便利条件兴风作浪,重新成为人类的劲敌。我们已经没有退路了,只能继续仰仗全球化带来的集团优势,在尊重国际共识的基础上相互合作,才能更好地发挥科学的力量,最终战胜它们。

(插图 范薇)
结语
疫苗研发成功,只是万里长征的第一步。接下来还要过生产、包装、运输、冷藏、分发、接种、效果检验等等好几关,每一关都不好过。
就拿生产来说,如今绝大多数疫苗企业的工作重点都是生产儿童疫苗和少数特殊需求疫苗(比如HPV),产能不是太大的问题。事实上,人类历史上从来没有任何一个疫苗品种的生产量达到过10亿这个级别,全世界只有少数几家疫苗工厂具备年产1亿剂疫苗的生产能力。即使是生产过程相对简单的核酸疫苗,也很难突破每年2亿剂的水平。但新冠疫苗要是投放市场的话,很可能需要每个地球人都打一针。如果疫苗的免疫原性不够强的话,甚至需要每个人再补上一针。这样算下来,所需疫苗的总量将是百亿级别的。因此科学家们估计,未来最有可能发生的情况就是全球有好几款新冠疫苗被批准,分别由不同的国家自行组织生产,以满足不同的市场需求,只有这样才能在短时间内让足够多的人打上疫苗,以此控制住新冠疫情的蔓延。
如此大规模的生产,必须要求各大制药企业共享疫苗生产的知识产权,否则将导致疫苗质量不均,达不到设计要求。专注于投资疫苗开发的非政府组织“流行病防范创新联盟”(CEPI)为此专门在合同里规定,凡是接受了该机构赞助的疫苗研发企业必须共享知识产权,美国政府在资助莫德纳公司的合同里也有类似的规定。
另外,这些疫苗很可能各有千秋,每一种疫苗都有自己的强项,也有自己的短处,每个人应该可以根据自己的独特需求选择最适合自己的疫苗,科学家们也可以通过对照研究,丰富免疫学知识,为将来可能出现的新传染病做好准备,这就是试验和竞争带来的好处。
疫苗生产出来之后需要装瓶,这对各国医疗级玻璃瓶的生产能力将是个巨大的考验。更难的也许是一次性注射器,仅在美国预计就需要增加8.5亿支注射器的产能,而美国往年的生产量仅仅是每年6.63亿支而已。
根据CEPI对全球各大疫苗生产厂家所做的统计,假设所有进入Ⅲ期临床试验的新冠疫苗全都进展顺利,生产过程也没有遇到太大的困难,到2021年底时也只能生产出20亿~40亿剂量的疫苗,远远满足不了全人类的接种需求。
虽然困难重重,但对于发达国家来说应该问题不大。比如欧美各国政府已经向各大制药厂预订了数以亿计的新冠疫苗,足以满足本国人民的接种需求。根据《自然》(Nature)杂志所做的统计,美国政府已经抢购了8亿剂疫苗,足够每位美国公民打2针。英国政府更厉害,已经预订了3.4亿剂疫苗,足以保证每位英国公民打5针!多数发展中国家的政府因为缺乏经费,估计只能等到发达国家全都接种完毕之后才能排上队。
为了解决疫苗分配的不公问题,由WHO、CEPI和GAVI这3家组织牵头的“新冠疫苗供应计划”(COVAX)正式启动,目标是在2021年底前为广大发展中国家提供至少20亿剂安全有效的新冠疫苗。世卫组织总干事谭德塞于8月24日宣布,目前已有172个国家和地区决定加入这项计划,但中国、美国、俄罗斯不在此列。
病毒是不分国界的,只要有一个国家控制不住疫情,我们的生活就无法完全回到正轨。
更多精彩报道详见本期新刊《通往新冠疫苗之路》,点击下方商品卡即可购买,