⑶.表示方法:离子的电荷数和电性标注在元素符号的左上方,如果电荷数为1,数字省略。如;氯离子:Cl-; 镁离子:Mg2 ; 氧离子:O2-;
表示意义:Al3 : 1个铝离子中含有1个原子核,13个质子,10个电子
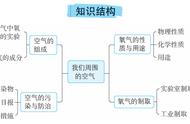
课题3、元素
⒈定义:具有相同核电荷数(即核内质子数)的一类原子的总称。例如水(H2O )分子中的氧原子、二氧化碳(CO2 )分子中的氧原子、氧分子(O2 )中的氧原子中都含有8个质子,这些原子都属于氧元素.
⒉元素(同一类)原子的总称,元素的种类决定于核电荷数(即核内质子数)。原子是构成元素的基本单元。(树林和树的关系就好比是元素和原子的关系)
注意:*一种元素与另一种元素的本质区别:质子数不同
⒊物质与元素间的关系:xx物质是由xx元素组成。
①由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
②元素是从宏观上描述物质的组成,只讲种类,不讲个数;目前已知的元素有100多种,组成3000多万种物质。

4、原子与分子;原子与元素:
5.地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。空气中含量最多的元素:氮
6.元素的分类:
金属元素 如:铁、铜、钠、镁、铝(钅字旁)
非金属元素 如:氧、氢、氟、硅、硫(固态非金属石字旁,液态 氵字旁,气态气字头)
稀有气体元素 如:氦、氖、氩 。
7 、元素符号表示的意义:
⑴元素符号前无数字:表示 xx元素
⑵元素符号前有数字:表示 几个xx原子
⑶由原子直接构成的物质,元素符号还表示该物质。如铁,碳,硅。

例如: H ①表示氢元素 ②表示一个氢原子
2H:表示二个氢原子 注意:元素不讲个数,2H不能说成二个氢元素。
9、元素周期表简介
①发现:门捷列夫 原子序数=质子数
②排列依据

*
③.元素周期表的结构
原子序数—— ————元素符号
(核电荷数) ———— 元素名称
————相对原子质量
⑴周期表每一横行叫做一个周期,共有7个周期。
⑵周期表每一个纵行叫做一族,共有16个族(8、9、10三个纵行共同组成一个族)。
口诀: 七个横行叫周期,一二三四五六七。
七个周期分长短,三短三长一不全
18纵行16族。 Ⅷ主、Ⅷ副、零和VIII
第五单元 化学方程式
课题1 质量守恒定律
1 量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
说明:⑴参加化学反应
的,所给予物质不一定都参加反应
,若反应物有剩余,剩余的物质没有参加反应,所以必须强调"参加化学反应"。
⑵质量总和"是参加化学反应的物质的质量总和和反应后生成的物质的质量总和"。如:镁在氧气中燃烧生成氧化镁,参加反应的镁的质量和参加反应的氧气的质量的和等于反应后生成的氧化镁的质量。
⑶质量守恒定
律只能用于解释化学变化,不能解释物理变化。
2 量守恒定律的分析归纳:
反应前后五个不变,两个一定改变,一个可能改变。
五不变
原子的种类不变
原子的
数目不变
原子的质量不变
反应物和生成物的总质量不变
两个一定改变
物质种类一定改
分子的种类一定改变
一个可能改变
分子总数可能改变,元素的化合价
⒋探究质量守恒定律的几个重要实验
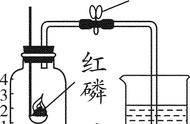
(1)磷燃烧前后质量的测定
⑵铁钉跟硫酸铜溶液反应前后质量的测定
⑶碳酸钠与盐酸反应后质量的测定
⑷镁条燃烧
⒌质量守恒定律的应用
⑴根据质量守恒定律进行简单的计算;
⑵运用质量守恒定律解释化学反
应中的一些简单的现象和问题;
⑶判断化学反应中某种物质的组成;
⑷确定化学反应中某种物质的化学式。
化学方程式
⒈化学方程式的定义:用化学式表示化学反应的式子。
3 学方程式提供的信息(意义)
1 些物质参加了反应(反应物是什么)
2 成了哪些物质(生成物是什
么)
3 应条件
4 反应物与生成物之间的粒子数量比(化学计量数之比)
⑸
反应物与生成物之间的质量比(相对分子质量×化学计量数)
说明:化学计量数就是化学方程式中每种物质化学式前的数字。
3. 学方
程式的读法 (以C O2 ===== CO2为例)
⑴宏观:在点燃的条件下,碳和氧气反应生成二氧化碳;
⑵微观:在点燃的条件下,每1个碳原子和一个氧分子反应,生成一个二氧
化碳分子。
⑶质量:在点燃的条件下,每12份质量的碳和32份质量的氧气完全反应,生成44份质 量的二氧化碳;
课题2如何正确书写 化学方程式
1、化学方程式的书写原则
1 客观事实为基础 ㈡遵循质量守恒定律
2、书写化学方程式的步骤:写-配-标-等-查
(1)写:根据实验事实,在式子两边写出反应物和生成物的化学式,并在两边之间画一条短线
(2)配:根据质量守恒定律配平化学方程式,将短线改为等号
(3)标:标明反应的条件和生成物的状态
怎样运用符合("↑"或"↓")首先必须知道气体符号和沉淀符号是对生成物而言的,不能标在反应物上其次要看反应物和生成物的状态来确定。
1 以下生成气体要用"↑"
固 固→气
固 液→气
液 液→气
2 以下生成气体不要用"↑"
3 固 气→气
4 液 气→气
5 气 气→气
以下生成沉淀要用"↓"
液 液→固
以下生成沉淀不要用"↓"
液 固→固
(4)等:短线改成等号
(5)查:检查化学式是否写错,化学方程式是否配平,条件和生成物的状态是否标明
3化学方程式的配平方法
最小公倍数法
观察法
奇数变偶数法
暂定分数配平法
课题3根据化学方程式的计算
1 题步骤及格式
1 设未知量,一般情况下,求什么设什么;(注意不能带单位)
2 写出相应
的正确的化学方程式;
3 写出相关物质的相对分子质量和(相对分子质量×化学计量数),写在相应的化学式正下方;写出已知量(带单位)和未知量;
4 比例式;
5 求出解;
6 答。
2、根据化学方程式计算的常见题型
1 求反应物、生成物各物质之间的质量比
2 已知某反应物的质量,求另一反应物或生成物的质量
3 已知某生成物的质量,求另一反应物或生成物的质量
2算中常用的关系式
1 m= ρv
2 单位换算:1L=1000mL,1mL=1cm3
3 物质的纯度=纯物质的质量/不纯物质的质量×100%
� ���
点燃
在实验过程中试管炸裂的原因可能是:
(1)试管底部低于管口
(2)试管外壁有水未擦干就加热
(3)加热时,试管底部接触灯芯
(4)未预热
(5)实验结束时,先熄灭酒精灯,水槽中的水倒流
(6)试管未冷却就放在实验台上或用水冲洗
注意事项:
(1)试管口应略向下倾斜
(2)试管夹夹在试管的中上部
(3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的气密性
(6)加热时,先预热且应用外焰加热
一价氢氯钾钠银,二价氧钙钡镁锌,
三铝四硅五价磷; 二三铁、二四碳,
二四六硫都齐全,
铜汞二价最常见,莫忘单质价为零。(注:氯、氧、二价硫是负价;其他都是正价)
其它元素有变价,先死后活来计算。
(二)
负一硝酸、氢氧根,
负二碳酸、硫酸根
负三记住磷酸根,
正一价的是铵根
����
原子
失去电子
原子带正电荷
阳离子
原子
得到电子
原子带负电荷
阴离子
阴阳离子相互作用形成化合物
7横行(7个周期)各周期电子层数相同,核电荷数逐渐增加
18纵行(16族) 各族最电外层电数相同,电子层数逐渐增加(化学性质相似)
8 O
氧
16.00
点燃