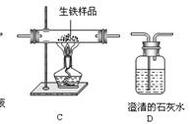
①实验室制取氯气的反应原理为MnO2(固体)+4HCl(浓)eq \o(=====,\s\up7(△))X+2H2O+Cl2↑,则X的化学式为________。
②实验室用图Z19-15所示装置可制取并收集一瓶纯净、干燥的氯气,导管口的正确连接顺序是a→______________________(填序号),其中饱和食盐水作用是____________________________。
4.[2017·烟台]图Z19-16是实验室制取常见气体及检验相关性质的装置图,据图回答问题。

(1)仪器①的名称是__________。
(2)查阅资料知,高铁酸钾(K2FeO4)固体可用于制取氧气。
方案一:4K2FeO4eq \o(=====,\s\up7(△))2Fe2O3+4K2O+3O2↑;
方案二:4K2FeO4+10H2O===4Fe(OH)3↓+8KOH+3O2↑。
①若用方案一制取氧气,应该选用的发生装置是________(填序号)。选用装置C用排空气法收集氧气时,氧气应该从________(填"a"或"b")端通入。
②下列关于以上两种方案制取氧气的说法正确的是________(填序号)。
a.方案一发生的是分解反应
b.方案二更简便、节能
c.制取等质量的氧气,两种方案所需高铁酸钾的质量相等
(3)实验室制取二氧化碳的化学方程式是________________________________________。二氧化碳的水溶液能使蓝色石蕊试纸变红,若用装置D证明蓝色石蕊试纸变红的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是________________________________________________________________________
(填序号,其中①②③可重复使用)。
①从f端通氮气
②从分液漏斗中滴加适量水
③从e端通二氧化碳
④将干燥的蓝色石蕊试纸放入D装置的广口瓶中
参考答案
|夯实基础|
1.B [解析] 实验室制取二氧化碳的药品是石灰石或大理石和稀盐酸,需选用固液常温型气体发生装置,制取氧气用加热高锰酸钾或加热氯酸钾和二氧化锰的混合物的方法,发生装置需选用固体加热型,用过氧化氢溶液和二氧化锰制取氧气,发生装置需选用固液常温型;因此实验室制取CO2和O2的发生装置可能相同,也可能不同,故A、C均错误;二氧化碳、氧气的密度都比空气大,都可用向上排空气法收集,但不能用向下排空气法收集,故B正确、D错误。
2.C [解析] 根据题意可知一氧化氮有毒,能与空气中的氧气迅速反应,所以不能用排空气法收集;一氧化氮难溶于水可用排水法收集,所以选C。
3.(1)①铁架台 ②分液漏斗
(2)2KMnO4eq \o(=====,\s\up7(△))K2MnO4+MnO2+O2↑或2KClO3eq \o(=====,\s\up7(MnO2),\s\do5(△))2KCl+3O2↑
先将导管移出水面,再熄灭酒精灯
(3)挥发性 CO2+Ca(OH)2===CaCO3↓+H2O
(4)B E
[解析] (2)气体收集完毕后,先将导管移出水面,再熄灭酒精灯,目的是防止水倒吸。(3)浓盐酸有挥发性,会导致收集的气体不纯。(4)实验室常用块状电石和水在常温下反应制取乙炔,采用固液常温型装置,因此制取乙炔的发生装置选B,乙炔是一种微溶于水的气体,密度与空气接近,只能用排水法收集,因此收集装置选E。
4.(1)2KMnO4eq \o(=====,\s\up7(△))K2MnO4+MnO2+O2↑
(2)

(3)BD
[解析] (3)装置C使用了分液漏斗,其下端管口不需要浸入液面以下,该装置可控制反应速率的快慢;装置D使用了长颈漏斗,为防止生成的气体从长颈漏斗逸出,故发生反应时长颈漏斗下端管口必须浸没在液体中;检查装置C的气密性可用滴液法,检查装置D的气密性可用注水法或抽气法,二者检查气密性的方法不同;装置C和D均可用于固体和液体在常温下制取气体,如用锌和稀硫酸制取氢气。
5.(1)长颈漏斗
(2)2KMnO4eq \o(=====,\s\up7(△))K2MnO4+MnO2+O2↑
气泡连续且均匀冒出
(3)CaCO3+2HCl===CaCl2+H2O+CO2↑
(4)D 将带火星的木条放在集气瓶口,观察木条是否复燃
(5)C E
6.(1)锥形瓶
(2)2KMnO4eq \o(=====,\s\up7(△))K2MnO4+MnO2+O2↑ AD
(3)把燃着的木条放在集气瓶口,若木条熄灭,说明收集满
(4)C (5)CD
[解析] (4)乙炔气体的制备选用的发生装置是固液不加热型,反应剧烈需控制反应速率,C装置是固液不加热型且可以控制反应速率。(5)氢气的密度小于空气,气体应该从b端管口进入;用于排水法收集氧气时,气体应该从b端管口进入;浓硫酸干燥CO2时,气体应该从a端管口进入,达到干燥的效果;瓶内装满氧气,要将氧气排出,水应该从a端管口进入。
7.(1)酒精灯 长颈漏斗
(2)B 2H2O2eq \o(=====,\s\up7(MnO2))2H2O+O2↑ 不纯
(3)稀盐酸 浓硫酸 c
(4)可随时控制反应的发生与停止
[解析] (2)实验室用过氧化氢溶液制取氧气属于固体和液体常温下的反应,因此发生装置选择B;装置A可用于固体加热制取气体,若用此装置采用高锰酸钾制取氧气存在缺陷,即试管口未放一小团棉花,使得加热时高锰酸钾粉末进入导管,致使制得的氧气不纯。(3)选择B装置制取二氧化碳时,从长颈漏斗加入稀盐酸,若要获得干燥的二氧化碳,可在装置D中加入干燥剂浓硫酸;如果用E装置收集该气体,由于二氧化碳密度比空气大,则气体从c端进入,即"长进短出"。(4)C装置中置有塑料多孔隔板,在隔板上放置固体药品石灰石,利用气体压强的原理可随时控制反应的发生与停止,而B装置则不具有此特点。
8.(1)锥形瓶
(2)防止生成的气体从长颈漏斗口逸出
(3)BD(或BE) (4)bce
(5)2KClO3eq \o(=====,\s\up7(MnO2),\s\do5(△))2KCl+3O2↑
[解析] (2)选择装置B制取气体时,为了防止生成的气体从长颈漏斗口逸出,长颈漏斗末端需要伸入液面以下。(3)用锌粒与稀硫酸制取氢气是固体和液体常温下的反应,因此发生装置选择B,氢气密度比空气小,难溶于水,因此可采用向下排空气法或排水法收集。(4)收集气体方法的选择要根据气体的性质确定,具体涉及气体的溶解性,即是否溶于水,气体的密度较空气密度的大小、是否与氧气反应等方面。(5)采用连接A、F、G进行实验,实验时F中蜡烛燃烧更旺,说明产生的气体具有助燃性,即氧气,蜡烛燃烧产生的二氧化碳气体使得G中的石蕊溶液变红色,故装置A为氯酸钾制取氧气。
9.(1)长颈漏斗
(2)2H2O2eq \o(=====,\s\up7(MnO2))2H2O+O2↑
导管口有连续而均匀的气泡冒出时
(3)ABD (4)浓硫酸 a
[解析] (3)B装置中有带孔的隔板,如果是固体和液体反应,把固体放在隔板上,结合调节弹簧夹可以控制固体和液体的接触情况,从而控制反应的开始和停止,因此可选用A、B、D组装发生装置。(4)F装置如果作为洗气装置,一般装入的是液体试剂浓硫酸,浓硫酸可干燥二氧化碳气体,因此若使用F装置干燥二氧化碳气体,可在F装置中加入浓硫酸,气体应从a口进,b管口出。
10.(1)漏斗 C 2KClO3eq \o(=====,\s\up7(MnO2),\s\do5(△))2KCl+3O2↑
(2)有孔塑料片上方 c 通过长颈漏斗向试管中加水至在长颈漏斗中形成水柱,一段时间内高度不下降
(3)B 液体不能与固体分离
(4)B b
[解析] (2)用铁片与稀盐酸在A装置中制备H2,铁片应放在有孔塑料片上方,可以控制反应的进行与停止。H2的密度比空气小,应用向下排空气法收集,用F装置收集时应从c端导入气体。用止水夹夹紧导管口的胶皮管后,通过长颈漏斗向试管中加水至在长颈漏斗中形成水柱,一段时间内高度不下降,则气密性良好。(3)可用于固液反应制备气体的装置有A、B、D、E,其中B装置不能使反应随时发生或停止,因为反应过程中若用止水夹夹紧胶皮管后,液体不能与固体分离,反应还在继续直至反应完全。(4)用过氧化氢溶液制备O2发生装置应选B,把F装满水,用排水法收集O2并测定气体体积,应从c端通入O2,在b端连接上一个量筒。
|能力提升|
1.(1)f g d e b c
(2)C 吸收空气中的水蒸气和二氧化碳,防止进入B装置
[解析] 空气通过A装置除去二氧化碳,通过D装置除去水,二者不能颠倒,否则经过A时气体中又混入了水蒸气;通过C装置除去氧气,最后剩下的氮气进入B装置,与镁反应生成氮化镁。
2.(1)①铁架台 ②长颈漏斗
(2)A 2KClO3eq \o(=====,\s\up7(MnO2),\s\do5(△))2KCl+3O2↑ 催化作用
(3)可随时控制反应的发生和停止 a
(4)C
[解析] (3)C装置比B装置多了弹簧夹,当夹紧弹簧夹时,氢气不能排出,则在容器上方将酸液压回长颈漏斗,使酸液与隔板上的锌粒分开,反应停止,当打开时,氢气逸出,酸液又与锌粒接触反应;用E装置收集H2,由于氢气密度小于空气密度,故应该从a端进入,将瓶内空气从b端排出。(4)实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,要先用饱和的氢氧化钠溶液除去氯化氢气体,再通过浓硫酸除掉水蒸气。注意将气体通过洗气装置时,应从长管通入,短管导出,因此导管气流方向连接顺序是c→d→a→b。
3.(1)长颈漏斗 ①②③⑥⑨或③⑤⑥⑨
2H2O2eq \o(=====,\s\up7(MnO2))2H2O+O2↑
(2)①MnCl2 ②d→e→b→c→g→f→h
除去浓盐酸挥发出的氯化氢气体
[解析] (1)实验室用石灰石和稀盐酸在常温下反应制取二氧化碳气体,反应物是固体和液体,反应不需加热,反应的发生装置应选用固液常温型,收集只能用向上排空气法,因此,制备和收集二氧化碳气体的仪器组合为①②③⑥⑨或者用锥形瓶作反应容器,其组合为③⑤⑥⑨;实验室用该装置制取氧气的反应物是过氧化氢溶液,二氧化锰固体作为催化剂,过氧化氢分解成水和氧气。(2)①根据化学方程式左右两边各原子的种类和数目不变,可判断出X的化学式为MnCl2。②要收集到纯净、干燥的氯气,应先除去浓盐酸挥发出的氯化氢气体,后用浓硫酸进行干燥,再用向上排空气法收集氯气,最后进行尾气处理,因此,导管接口的正确顺序是a→d→e→b→c→g→f→h;饱和食盐水与氯气不反应,但能溶解氯化氢气体,因此,其作用是除去氯气中的氯化氢气体。
4.(1)锥形瓶
(2)①B a ②abc
(3)CaCO3+2HCl===CaCl2+H2O+CO2↑
④③①②③
[解析] (2)①方案一为加热高铁酸钾固体制取氧气,故选用发生装置B;若用装置C收集氧气,由于氧气密度大于空气,故需采用向上排空气法收集,即氧气从a端通入,空气从b端排出;②方案一的反应是由一种物质生成三种物质,该反应属于分解反应,a正确;方案二只需将高铁酸钾固体与水反应且不需加热,节能、简便,b正确;由方案一和方案二的化学方程式可以看出,两个反应中高铁酸钾与氧气的分子个数比相同,故制取相同质量的氧气,两种方案所需的高铁酸钾质量相等,c正确。(3)若要用D装置验证能使蓝色石蕊试纸变红的不是水或CO2,而是CO2与水反应生成的碳酸,则需首先将干燥的蓝色石蕊试纸放入装置D中,通入CO2观察是否能使干燥的石蕊试纸变红,然后用氮气将装置内的CO2排出,接着在氮气中将水滴到石蕊试纸上观察是否变红,最后再通入CO2排出氮气,观察此时湿润的蓝色石蕊试纸是否变红。