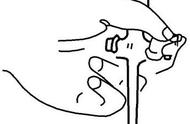
图4BALF标本载玻片示意图
(二)染色
1.常用染色方法包括迪夫快速染色(Diff-quick stain),革兰染色(Gram stain);特殊染色包括六胺银染色(Hexamine silver staining)、墨汁染色(India ink staining)等。(1)迪夫快速染色:①迪夫A(Diff quik A)溶液,主要成分为曙红、甲醇;②迪夫B(Diff quik B)溶液,主要成分为亚甲蓝;③磷酸盐缓冲液,主要成分为磷酸盐。分别把迪夫A溶液、迪夫B溶液、磷酸盐缓冲溶液适量倒于带盖的染缸中;把干燥后的玻片浸泡在迪夫A溶液中20~30 s;于磷酸盐缓冲溶液中洗掉迪夫A溶液,稍甩干缓冲液;再把涂片浸泡于迪夫B溶液中20~30 s;水洗、干燥、镜检。(2)革兰染色:革兰染色一般包括初染、媒染、脱色、复染等4个步骤,具体操作方法是:①涂片、干燥同上,固定方法:常用高温进行固定。即手持载玻片一端,标本面朝上,将涂有标本的载玻片快速来回通过酒精灯外焰3~4次,共约3~4 s,冷却后进行染色。要求玻片温度不超过60 ℃,以玻片背面触及手背皮肤不觉过烫为宜;也可选择丙酮固定。②草酸铵结晶紫染1 min后自来水冲洗;③加碘液覆盖涂面染约1 min后自来水冲洗;④加95%酒精数滴,并轻轻摇动进行脱色,30 s后自来水冲洗;⑤蕃红染色液(稀)染30 s后,自来水冲洗。干燥,镜检。
(三)标本评价
1.合格BALF标本为低倍镜下鳞状上皮细胞占全部细胞(不包括红细胞)的比例<1%,柱状上皮细胞<5%时,红细胞<10%(除外创伤/出血因素);若标本质量不合格,需在报告单中注明[3,55]。鳞状上皮细胞比例大于5%,表明标本包含上呼吸道成分,不建议送检二代测序,常规培养仍可送检(结果仅供参考)。
2.健康非吸烟者的BALF细胞构成的参考值范围为:巨噬细胞>85%,淋巴细胞10%~15%,中性粒细胞≤3%,嗜酸粒细胞≤1%,鳞状上皮细胞或纤毛柱状上皮细胞均≤5%[2]。健康吸烟者的BALF中细胞总数明显增高,一般为不吸烟者的3~5倍,增多的细胞主要为肺泡巨噬细胞和中性粒细胞[42,57]。
(四)标本快速现场评价
1.细胞学评价可使用迪夫快速染色,优点包括不需要立即固定,细胞损失少。染色过程简单、快速,且更容易识别细胞质和内含物[58](图1)。(1)淋巴细胞>15%:提示结节病、非特异性间质性肺炎、过敏性肺炎、药物性肺炎、胶原血管病、放射性肺炎、隐源性机化性肺炎、淋巴增殖性病变等。其中当淋巴细胞计数>25%时提示肉芽肿性疾病(结节病、过敏性肺炎或慢性铍病)、非特异性间质性肺炎、药物反应、淋巴间质性肺炎、隐源性机化性肺炎或淋巴瘤,当淋巴细胞计数>50%时强烈提示过敏性肺炎或富细胞型非特异性间质性肺炎。(2)中性粒细胞>3%:提示胶原血管病、特发性肺纤维化、吸入性肺炎、细菌或真菌感染、支气管炎、石棉肺、急性呼吸窘迫综合征(ARDS)、弥漫性肺泡损伤等。其中当中性粒细胞计数>50%时常强烈提示急性肺损伤、吸入性肺炎或化脓性感染。(3)嗜酸粒细胞>1%:提示嗜酸粒细胞肺炎、药物性肺炎、骨髓移植、哮喘、支气管炎、变应性肉芽肿性血管炎、过敏性支气管肺曲霉菌病、感染(细菌、真菌、蠕虫、肺孢子虫)、霍奇金病。另外,嗜酸粒细胞计数是否>25%可鉴别急性或慢性嗜酸粒细胞肺炎。(4)当肥大细胞>1%、淋巴细胞>50%和中性粒细胞>3%时,强烈提示急性过敏性肺炎[3]。(5)如见中性粒细胞或巨噬细胞吞噬病原微生物现象,需报告吞噬细胞所占同种细胞百分比,吞噬比例大于5%提示感染,吞噬病原菌为致病菌。
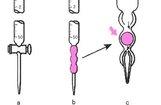
2.微生物学评价可使用革兰染色或迪夫快速染色(图5)。有经验的医师可辨别出常见的真菌和部分细菌。如念珠菌,曲霉,毛霉,隐球菌,金黄色葡萄球菌,肺炎链球菌,肺炎克雷伯菌,铜绿假单胞菌和鲍曼不动杆菌等,若结合特殊染色识别率更高。

图5BALF标本快速现场评价方法。图A和图C为迪夫快速染色(低倍放大),图B和图D为革兰染色(高倍放大),箭头为中性粒细胞吞噬现象
3.采用二步法观察涂片:先用低倍镜(40或100倍)扫描全片,观察是否存在可疑细胞、粗大菌丝,再用高倍镜(400或1 000倍)作细胞分类、鉴定细胞性质、观察微生物形态、判断微生物数量及有无中性粒细胞吞噬现象(图5A和图5D)。
(五)BALF淀粉酶
BALF淀粉酶浓度随误吸危险因素的数量增加而增加,BALF淀粉酶浓度超过125.9 U/L可以高度怀疑发生误吸,且浓度高于125 U/L患者的细菌性肺炎患病率明显增加。BAL淀粉酶有一个相对较长的检测窗口,即误吸后72 h以内仍可检测到升高的淀粉酶[59]。
六、BALF的保存及送检
对于ICU患者的BALF标本,建议使用有机硅涂层玻璃或聚丙烯或其他用于悬浮组织培养的塑料无菌容器收集。送检量一般需要≥5 ml,建议10~20 ml[2]。新冠肺炎等烈性呼吸道传染病患者BALF标本要严格按照生物安全有关要求对样品进行包装盒运送,需要时,运送箱的表面可用有效氯500~1 000 mg/L的含氯消毒剂擦拭或者喷洒至表面湿润进行消毒,消毒15 min。
(一)涂片及培养
1.普通细菌、真菌涂片及培养的BALF标本:无菌容器,标本>1 ml,室温保存≤2 h,超过2 h,4 ℃保存≤24 h。如转运时间≥2 h,宜使用转运培养基或在冷藏条件下转运[60]。
2.对周围环境或对低温敏感的细菌(如流感嗜血杆菌和肺炎链球菌等)的标本:采集后不宜冷藏,应立即送检。
3.如怀疑厌氧菌感染,可以考虑床旁采样。如不能床旁采样可常温下转运,宜在采集后30 min内送至实验室,转运过程中标本尽可能与空气隔绝。
4.病毒培养:室温保存≤2 h,4 ℃保存≤5 d。超过5 d,需-70 ℃保存[61]。
5.寄生虫:镜检虫卵,新鲜标本4 ℃保存≤1 h[61]。
(二)抗原抗体检验[61]
1.病毒快速抗原及直接荧光抗体检验:室温保存≤2 h,4 ℃保存≤5 d。超过5 d,需-70 ℃保存。
2.真菌(1-3)-β-D-葡聚糖(G试验):室温保存≤2 h,4 ℃保存≤5 d。超过5 d,需-70 ℃保存。
3.曲霉半乳甘露聚糖抗原(galactomannan,GM)检测:室温保存≤4 h,4 ℃保存≤24 h。超过24 h,宜在-20 ℃条件下,可存放11个月[3,61,62]。
4.组织胞浆菌抗原室温保存≤2 h,4 ℃保存≤72 h。
5.皮炎芽生菌抗原4 ℃保存≤2~14 d。
6.肺孢子菌直接荧光抗体检测室温保存≤2 h,4 ℃保存≤7 d。
(三)分子诊断[如核酸扩增检测、聚合酶链反应技术、宏基因组新一代测序技术(metagenomics next-generation sequencing,mNGS)等]
1.标本采集:无需任何预处理、新鲜合格的BALF收集于干燥无菌、无DNA/RNA酶的冻存管中,送检量不少于3 ml。
2.标本保存:细菌真菌等分子诊断检测,若不能及时进行冻存,4 ℃保存≤24 h。如进行核糖核苷酸(RNA)建库测序,样本需在-70 ℃以下保存,且不应超过6个月;如进行脱氧核糖核苷酸(DNA)建库测序,样本在-20 ℃保存≤1周,-70 ℃以下可长期保存。病毒核酸检验,室温保存≤30 min,4 ℃保存≤4 h,超过4 h需-70℃保存。
3.标本转运:宜在-70 ℃或更低温度下转运。标本需采用干冰(干冰温度为-78.5 ℃)在医用冷藏加厚泡沫箱里进行密封运输,且需保证标本在送至检测单位时仍有干冰覆盖(防止优势菌群的生长或者RNA病毒的降解)。在运送过程中宜保存在适当的病毒转运液或其他相应的缓冲液中[63]。
4.储存样本必须避免反复冻融。
(四)BALF细胞计数和分类、T淋巴细胞亚群、细胞学检测
室温保存≤30 min。如果标本在30~60 min后到达实验室,建议4 ℃(冰上)保存运输。如果标本超过60 min后到达实验室,建议先250~300 g离心10 min(保持细胞完整性),然后悬浮于营养液,4 ℃保存≤24 h。BALF标本不应冷冻或干冰运输。超过24 h的标本不再适合细胞计数及分类[2]。
七、BALF分类计数
(一)送检的量
用无菌容器收集BALF标本,送检量为10~20 ml(至少5 ml)[2,3],贴好标本信息。
(二)操作流程
1.标本送至实验室后,需立即处理。先观察灌洗液的性状、颜色和总量,并记录。如果含有黏液成分的标本,可用无菌纱布过滤或使用0.1%的二硫苏糖醇进行溶解,并记录处理后的总量[2]。
2.将上述回收灌洗液在4 ℃下,以250~300 g离心10 min,细胞沉淀重悬于3~5 ml细胞培养基,如MEM 125 mmol/L HEPES或RPMI1640 125 mmol/L HEPES,制成细胞悬液(也可用生理盐水或不含Ca2 离子和Mg2 离子的Hank′s液重悬)[2,55,64]。上清液在-70 ℃储存,用做可溶性成分的检测。
3.在计数板上计数BALF中细胞总数,一般以1×106/ml表示。如果细胞数过高时,再用细胞重悬液稀释,调整细胞数为5×106/ml,并同时将试管浸入碎冰块中备用[55]。
4.采用细胞离心涂片装置,加入备用细胞悬液(细胞浓度为5×106/ml)100 μl,在4 ℃下以(250~300)×g离心10 min,通过离心作用将一定数量的BALF细胞直接平铺于载玻片上。取下载玻片立即冷风吹干,一般用瑞氏-姬姆萨复合染色法(Wright-Giemsa staining)或苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色[2,41,55,64,65]。
5.先在低倍光学显微镜(<40倍)下观察整张片子的情况,然后在高倍光学显微镜下(≥40倍)计数至少400个细胞,进行细胞分类计数[2,3]。支气管灌洗液中常见细胞形态见图6。
图6常见支气管灌洗液中各类细胞的形态(HE 高倍放大)。图A~G分别为肺泡巨噬细胞、中性粒细胞、淋巴细胞、嗜酸粒细胞、不合格标本、尘细胞、肺泡蛋白沉积症患者灌洗液
(三)注意事项
1.标本采集后,需立即送检。室温1 h内送至实验室,如超1 h,需(250~300)×g离心10 min后,在细胞培养基中重新悬浮,并在4 ℃下保存,可保留24 h。如没有离心机,可将细胞培养基直接添加到灌洗样本中,在4 ℃下可保留12 h。标本不能冻存[2]。
2.第1管回吸收液不建议做常规细胞学分析。
八、BALF的微生物检验
(一)显微镜检查
1.革兰染色:
用于分辨革兰阳性和阴性细菌,阳性菌染色为蓝紫色,阴性细菌染色为红色。同时观察白细胞情况,如果见到吞噬菌现象,须报告吞噬细菌的种类及吞噬细菌的中性粒细胞占或全部中性粒细胞的比例。
2.抗酸染色和弱抗酸染色:
用于检测分枝杆菌,弱抗酸染色主要用于检测奴卡菌。两者染色均为红色,背景及非抗酸菌染为蓝色。
3.荧光染色:
利用荧光染料及荧光标记抗体特异性结合不同种类病原体的特性来检测病原微生物,如真菌、军团菌、肺孢子菌及呼吸道感染病毒,特异度强、敏感度高。
4.瑞氏染色:
细菌染成蓝色,组织细胞的细胞质呈红色,细胞核呈蓝色,嗜酸颗粒染成橘红色。
5.六胺银染色:
常用于肺孢子菌的检测,也可用于隐球菌,念珠菌和丝状真菌的检测。真菌孢子和菌丝被染成黑褐色。
6.墨汁染色:
主要用于隐球菌的检测。低倍镜下观察,黑色背景中可见隐球菌宽厚透亮的荚膜。
7.异染颗粒染色:
用于白喉棒状杆菌染色,异染颗粒可明显地被显示出来。
8.芽孢染色石碳酸复红染色:
芽孢呈红色,菌体呈蓝色。
(二)培养
1.一般培养:
涡旋震荡BALF标本1 min,BALF标本(1 500~1 800)×g离心15~20 min。细菌培养接种于血平板及麦康凯(或中国蓝)平板,置普通培养箱35~37 ℃培养,巧克力平板,置于5% CO2培养箱35~37 ℃培养。真菌培养接种于沙保弱培养基(或显色培养基)于25 ℃培养。普通细菌培养至少2 d,念珠菌培养5 d,对于慢生长细菌及双相真菌或部分丝状真菌需适当延长培养时间。
2.结核分枝杆菌培养:
灌洗液3 000 g离心15 min,灌洗液离心后取适量沉渣,加入溴化麝香草酚蓝指示剂(bromthymol blue indicator,BTB)1~2滴,用2%~4%氢氧化钠中和,接种于改良罗氏培养基,或BD公司结核分枝杆菌液体培养基。置于35~37 ℃培养,第1周观察2次,以后每周1次,直至6周,方可出阴性报告。阳性者观察菌落出现时间与形态,并进一步鉴定。
3.军团菌培养:
灌洗液离心,经加热或酸处理后,接种于缓冲炭酵母提取物琼脂基础(buffered charcoal yeast extract agar,BCYE)培养基、血平板和巧克力平板,置于5% CO2孵箱培养。若BCYE培养基24 h内有细菌生长,此菌不是军团菌,若48 h后生长,而血平板和巧克力平板不生长,此菌可能是军团菌,应进一步鉴定。
(三)核酸检测及抗原检测
1.核酸检测(包括全基因组测序等方法):可用于几乎所有病原菌的检测。
2.抗原检测半乳甘露聚糖试验(GM试验)主要用于曲霉的检测[66]。军团菌、肺炎链球菌、新型隐球菌、肺孢子菌、病毒、寄生虫等多种致病因子均可使用特异抗原检测方法[61,67,68,69,70]。
九、BALF的核酸检测
(一)宏基因组下一代测序技术(metagenomics next-generation sequencing,mNGS)
1.基本要求:
根据患者的临床特征,在样本送检时医生需选择出相应的测序模式(表1)。为保证检测的准确性及时效性,临床医生应尽量将样本送往通量高、运行快速、测序准确性高的测序平台。ICU送检的每个测试的有效测序数据量要求:建议不低于10 mol/L检出序列数(reads),检出序列数越大,敏感度可能越高。
2.测序报告临床解读:
(1)报告数据的基本解读:测序报告中需含有表2中所列的8个主要关键数据,在解读报告时,临床医生需了解报告中这8个关键名词含义并充分掌握这些概念,除了上述8个主要关键数据,推荐在测序报告中列出检出病原微生物的种属情况。在检测平台的背景数据库扣除背景菌、定植菌、污染菌后,某一/某些病原体的检出序列数占测序实际产出序列总数的比例越高,且病原体的测序深度、覆盖度、离散度越大,则该病原体被检出的可信度越高,最后还要结合临床特征综合判断[75,76,77]。(2)对于报告中所列病原体的临床考虑,临床医生需合理的参照以下原则对测序报告进行临床判读:①如果检测报告中所示的检出序列数较高、基因组覆盖度高的某一(或某些)微生物是呼吸系统社区感染的常见病原体或者其他不常见的致病病原体,则应优先考虑这类病原体为致病病原。②如果检测报告中所示的检出序列数较高、基因组覆盖度高的某一(或某些)微生物是呼吸科ICU常见的条件致病病原体或者是呼吸道常见的定植菌(需要医生通过临床病原数据的积累进行判断),则应先不考虑此类病原体为致病病原。③如果检测报告中所示的病原体特异序列数较低,但属于罕见病原体(如诺卡菌)或者胞内菌(如结核)等类型的病原体时,也应考虑其为致病病原,可结合临床症状来进行判读。④如果医生高度怀疑的病原体未在检测报告中显示时,医生可要求对测序平台的原始数据库进行重新分析和溯源查询,所以要求测序平台对临床样本检测的原始数据及信息分析数据的保存时间不少于2个月。