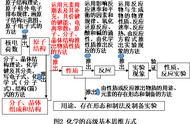
在高中化学中,物质的先后反应是一大重点,掌握好优先原则是学习好化学的基本条件,本篇文章将总结高中化学中常见的反应优先原则
⭐️化学先后反应的判断可分为两大类型
一、氧化还原反应型
二、非氧化还原反应
⭐️一、氧化还原反应型⭐️
在氧化还原中,经常遇到同一种氧化剂与多种还原剂反应,或
同一还原剂与多种氧化剂反应。要解答这类问题,就必须考虑
反应先后顺序。
一般来说,含多种还原剂的溶液中加入一种氧化剂时,还原性强的还原剂(离子)先被氧化;反之,含多种氧化剂的溶液中,加入一种还原剂时,氧化性强的氧化剂(离子)先被还原。
最常见的例子:
将Cl2 通入含Fe2 和Br-的溶液中,反应的过程什么?
根据已学知识Fe3 和Br-可以共存,还原性:Fe2 >Br-,所以Cl2 先和Fe2 反应,反应方程式为Cl2 2Fe2 ==2Fe3 2Cl-;当Fe2 完全反应后,Cl2 再与Br-反应,反应方程式为Cl2 2Br-==Br2 2Cl-
那该如何判断溶液中离子氧化性和还原性的强弱?
1.通过反应物和生成物判断
在氧化还原反应中,氧化性:氧化剂>氧化产物 ,还原性:还原剂>还原产物。
【例1】
2Fe3 十Cu=2Fe2 十Cu2
所以Fe3氧化性>Cu2 氧化性
【例2】
例:已知以下反应,
(1)2BrO3- Cl2 = Br2 2ClO3-
(2)5Cl2 I2 6H2O = 2HIO3 10Hcl
(3)ClO3- 5Cl- 6H = 3Cl2↑ 3H2O
请将BrO3- ,ClO3- ,Cl2 ,ClO3- 按氧化性由强到弱排序。
【分析】
按照氧化剂>氧化产物排序即可。注意价态的变化,氧化剂对应还原产物,还原剂对应氧化产物。
(1)2BrO3- (氧化剂) Cl2 = Br2 2ClO3- (氧化产物)
氧化性:BrO3- >ClO3-
(2)5Cl2 (氧化剂) I2 6H2O = 2HIO3(氧化产物) 10HCl
氧化性:Cl2>HIO3
(3)ClO3- (氧化剂) 5Cl- 6H = 3Cl2↑(氧化产物) 3H2O
氧化性:ClO3->Cl2
综上,氧化性:BrO3->ClO3->Cl2>HIO3
2.通过单质的活泼性判断
金属单质越活泼,还原性越强,非金属单质越活泼,氧化性越强。
先看下金属活动顺序表
还原性依次递减
K Ca Na Mg Al Zn Fe (锡)Sn (铅)Pb (H) Cu (汞)Hg Ag (铂)Pt (金)Au
而单质的还原性越强,离子的氧化性越弱。
例如
依照金属活动顺序表
可以判断还原性
Ag<Hg< Fe3< Cu2< H
则氧化性Ag >Hg2 > Fe3 > Cu2 > H
3.通过反应难易程度来判断
反应条件越容易,氧化性/还原性越强。反应条件越难,性能越弱。
例如:
2KMnO4+16HCl(浓) = 5Cl2↑+2MnCl2+2KCl+8H2O
MnO2 4HCl(浓)=△= MnCl2 Cl2↑ 2H2O
不同的氧化剂把HCl都氧化成Cl2,反应条件一个加热一个不加热,不加热的氧化性更强。
4.通过变价幅度来判断
例:Fe Cl2 → FeCl3
Fe S → FeS
S和Cl2在氧化Fe时,一个氧化到 2价,一个氧化到 3价,这样也能比较出S和Cl2的氧化性强弱:Cl2>S
5.影响氧化剂的氧化性、还原剂的还原性的其它因素
①温度:如浓硫酸具有强氧化性,热的浓硫酸比冷的浓硫酸氧化性要强。
②浓度:如硝酸具有强氧化性,硝酸越浓其氧化性越强。
③酸碱性:如KMnO2的氧化性随溶液酸性的增强而增强(一般地,在酸性环境中,KMnO4的还原产物Mn2 ,在中性环境中,KMnO4的还原产物为MnO2,在碱性环境中,KMnO4的还原产物为K2MnO4)。
⭐️ 二、非氧化还原反应⭐️
在非氧化还原反应(主要就是复分解反应)的离子反应中,由于无法通过上述的氧化性和还原性比较的方法来解释,所以相对比较复杂,我们可以用以下方法来解决
1.假设法。如某溶液中存在Na 、Alo2-、CO32-和OH-,向该溶液中滴加HCl,问产生现象的顺序是什么,并写出相关的离子反应方程式。现在我们先判断一下离子间的反应顺序,然后根据反应顺序再得出相应的现象和离子反应式,因为Alo2-、CO32-和OH-都要和H 反应,我们可以假设H 先和Alo2-反应,那么生成的Al(OH)3又要与原溶液中的OH-反应,而重新生成Alo2-,即假设不成立。同理,假设H 先与另外两个反应。通过假设可以判断出离子反应顺序为OH->Alo2->CO32-
⭐️2.根据反应后生成物的溶解度来判断,生成物溶解度越小(可以理解为生成的物质越稳定)的离子越先反应,但有时也要考虑离子共存(例如双水解)的影响。
如在含有NH4 、Al3 、H 、Mg2 溶液中逐滴滴入NaOH,请依次写出各步反应的离子方程式。根据离子反应条件,上述离子均能与OH-反应生成难电离的物质及沉淀而反应,但有先后问题,由于H2 O是极弱的电解质,是高中化学所学最弱的电解质[且H 与Mg(OH)2 及Al(OH)3 不共存],故H 优先于其他离子先与OH-反应,而Mg2 与Al3 优先于NH 4 反应,
原因:(因为沉淀(Al(OH)3和Mg(OH)2)比NH3· H2O更难电离或者说解释为NH 与OH-生成的NH3 ·H2 O又可与Mg2 及Al3 反应后变成NH )
再由于生成的Al(OH)3 更弱更难溶更稳定,所以Al3 优先于Mg2 反应,Mg2 优先NH4 反应,
此时反应顺序为H >Al3 >Mg2
此时剩下的是NH4 可与OH-反应外,还有刚才已经反应生成的Al(OH)3 也可与OH-反应,哪一个优先反应呢?
可借助双水解判断。假设Al(OH)3 先反应,则生成的AlO2- 与NH4 又发生水解而不能共存,重新生成Al(OH)3 及NH3 ·H2 O,所以NH 4 先反应,Al(OH)3 后反应。
所以综合顺序是
①氢氧根离子先与氢离子反应 H OH - =H 2 O
②再与铝离子反应 Al 3 3OH - =Al(OH) 3 ↓
③再与铵根离子反应 NH 4 OH - =NH 3 ·H 2 O
④最后与Al(OH) 3 反应 Al(OH) 3 OH - =AlO 2 - 2H 2 O
⭐️3.根据反应后生成物的电离程度来判断,其生成物电离程度越小的离子越先反应,
如在CH3 COONa,NaHCO3 ,C6 H5 ONa的混合溶液中,逐滴加入盐酸,请依次写出各步离子方程式。根据离子反应条件,生成沉淀、气体、难电离的物质方可发生离子反应,CH3 COO-、HCO 、C6 H5 O-均可与H 生成难电离的弱电质而发生反应,由于HCl是逐滴滴入的,所以H 浓度逐渐增大,只有最弱的电解质酸根C6 H5 O-最先与溶液中H 达到电离平衡生成弱电解质,所以生成的电解质越弱、越难电离,则该离子反应最先发生。由于酸性顺序是:CH3 COOH>H2 CO3 >C6 H5 OH,三个离子反应的顺序应为:
①C6 H5 O- H ==C6 H5 OH
②HCO H ==H2 CO3
③CH3 COO- H ==CH3 COOH。
获取更多学习资料➡️公众号:小博士课源
,