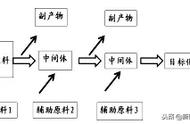
②、臭氧(O3看成OO2)分子的中心氧原子采用sp2杂化轨道,共三条sp2轨道,其中两条与另外两个氧原子的一个含单电子的p轨道重叠形成两条σ键,中心氧原子的另一个sp2轨道被一对孤对电子占据。此外中心氧原子还有一对电子在没有参与杂化的2p轨道上,另外两个氧原子的2p轨道又各有一个电子,这些没参与杂化的p轨道互相平行重叠形成一个三中心四电子的大π键 [Π3(4)] 。
③、硝酸根(NO3-):
1/2× (5 1-3×2) =0 孤电子对数为0 ,中心原子N和三个O结合,说明N原子为sp2 杂化,正三角形。N和三个O分别形成一个σ键 ,此时N还有2个电子, 每个O各提供一个p电子, 加上所带的一个负电荷,一共6个电子形成四中心六电子的大π键[ Π4(6) ] 。
④、臭氧(臭氧和二氧化硫、NO2-是等电子体,等电子体具有相似的空间结构和杂化类型,形成的离域大π键也相同)



⑤CO2