氧化还原反应
负极永远失电子,发生氧化反应,还原剂在负极被氧化
正极永远得电子,发生还原反应,氧化剂在正极被还原
注:一般情况下阳离子的电子,阴离子失电子
电解质溶液

碱性电解质:溶液中二氧化碳不可能存在,也不可能有氢离子参加反应
酸性电解质不可能有氢氧根离子参加反应
水溶液中不出现氧离子,只有固体介质中才有氧离子
非水溶液中氧气一般生成氧离子

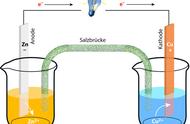
性质总结:外电路,电子方向为从负极到正极,电流方向为从正极到负极
内电路(盐桥中):阳离子移向正极,阴离子移向负极(原电池中)
盐桥:装有饱和的氯化钠、硝酸钠等溶液和琼胶制成的胶冻
盐桥的作用:连接内电路,形成闭合电路、平衡电荷使原电池不断产生电流
注:
1. 盐桥中的离子不断释放到两个池中,逐渐失去导电作用,需要定期更换盐桥
2. 盐桥原电池中还原剂在负极区,而氧化剂在正极区

书写电解质溶液中点解式的规律如下
规律一:正极的氧气变化:1.酸性条件下氧气的电子与氢离子反应变成水
2.碱性条件下氧气的电子与水反应变成氢氧根离子
3.固体介质时氧气的电子变成氧离子
4.碳酸盐时氧气的电子与二氧化碳反应变成碳酸根离子
规律二:正极的生成物一定是负极反应物中的一个物质
据此两个规律可通过正极来推出负极的反应方程式
,