一些同学在学习原电池的过程中,由于思考不够深入,对于电化学的基本反应规律陷入了认识的误区,想当然地认为“规律就是这样”,导致审题出现偏差,错而不知。
现对5种典型的原电池进行分析,希望可以在一定程度上帮助学生梳理思路!
- 【正常型】
第一类:最简单的经典模型之一
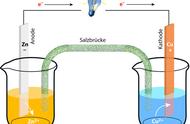
相信大家最初接触的原电池就是Cu-Zn原电池(如下图所示)。

当化学老师在课堂上展示这个实验时,大家都认为气泡应该在Zn表面冒出(这是初中化学的经验),但是由于一根“多余的”导线,气泡却在Cu表面冒出,正是这一神奇的现象让大家感受到了化学的无穷魅力,同时引发了同学们的积极思考:这是咋回事啊?
通过讨论,我们知道了原来是Zn失去的电子都跑到了Cu的身上,溶液中的氢离子只能去Cu表面得电子,最终被还原为氢气!
通过研究这个模型,我们还学到了:①原电池的反应必须是自发的氧化还原反应;②活泼金属作负极;③外电路电子定向移动,内电路离子定向移动等规律。
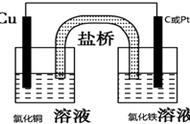
第二类:盐桥模型
实验过程中,我们发现第一类的单液电池在反应一段时间后,电流变得微弱,呈现不稳定的状态。这是由于负极产生的锌离子来不及离开而在Zn电极附近堆积,负极区附近带明显正电,这些带正电的锌离子对电子有束缚作用,不利于电子的失去;同时正极区氢离子的减少,带负电的硫酸根离子来不及离开而在正极堆积,正极区附近带明显负电,这些带负电的锌离子对电子有排斥作用,最终导致电流减弱。
为了保持正负极两侧溶液电中性、输出稳定电流,我们又引入了盐桥,就是下面经典的双液电池(如下图所示)。

反应过程中,盐桥中的氯离子向左侧(负极)的硫酸锌溶液移动,从而与负极区多余锌离子形成中性溶液,解除了对电子的束缚力;同时盐桥中的钾离子向右侧(正极)的硫酸铜溶液移动,与正极区多余的硫酸根离子形成中性溶液,解除了对电子的排斥力。这样就得到了稳定的电流。
第三类:燃料电池
接触了燃料电池(如下图所示),我们知道了原电池怎么反应并不全是电极说了算。下面的电池的两个电极是石墨电极(惰性电极),并不参加反应。真正参加反应的是氢气和氧气。