一、 概念和反应本质
原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
二、原电池的构成

⒈ 构成条件
⑴ 有两个活泼性不同的电极(常见为金属或石墨)。
⑵ 将电极插入电解质溶液或熔融电解质中。
⑶ 两电极间构成闭合回路(两电极接触或用导线连接)。
⒉ 构成条件三看
⑴ 一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
⑵ 二看两电极:一般是活泼性不同的两电极(金属或非金属导体,燃料电池的电极一般为惰性电极)。
⑶ 三看是否形成闭合回路。形成闭合回路需三个条件:
① 电解质溶液;
② 两电极直接或间接接触;
③ 两电极插入电解质溶液中。
三、 原电池中的三个方向:
⒈ 电子方向:从负极流出沿导线流入正极;
⒉ 电流方向:从正极沿导线流向负极;
⒊ 离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
电子流向的分析方法:改变条件,平衡移动;平衡移动,电子转移;电子转移,判断区域;根据区域,判断流向;根据流向,判断电极。
四、工作原理
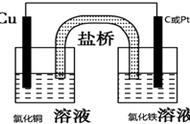
以Cu-Zn原电池为例

⒈ 盐桥的组成:
盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
⒉ 盐桥的作用:
⑴ 连接内电路,形成闭合回路;
⑵ 平衡电荷,使原电池不断产生电流。
⒊ 电极反应:
负极:Zn-2e-=Zn2
正极:Cu2++2e-=Cu
电池总反应:
CuSO4+Zn=ZnSO4+Cu
还原剂:Zn;氧化剂:CuSO4
⒋ 工作原理:
铜锌电池是由一个插入CuSO4溶液中的铜电极组成的“半电池”和另一个插入ZnSO4溶液中的锌电极组成的半电池所组成。两个半电池以一个称为“盐桥”,倒置的U形管连接起来,管中装满用饱和KCl溶液和琼脂作成的凝胶。在原电池装置中,电子由Zn负极经导线向Cu正极,阳离子Cu2 在正极上获得电子;通过电路中的电子和溶液中的离子的移动而形成回路,传导电流,这时,如果用导线将两极连接,并且中间串联一个电流计,电流计指针将发生偏转,说明线路上有电流通过。
五、 与原电池原理有关的辨析
理解原电池的工作原理的注意点
⒈ 只有放热的氧化还原反应才能通过设计成原电池将化学能转化为电能。
⒉ 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同形成了一个完整的闭合回路。
⒊ 不论在原电池还是在电解池中,电子均不能通过电解质溶液。
⒋ 原电池负极失去电子的总数等于正极得到电子的总数。
⒌ 原电池闭合回路的形成有多种方式,可以是导线连接两个电极,也可以是两电极相接触。
六、 特别说明
⒈ 在原电池装置中,电子由负极经导线向正极,阳离子在正极上获得电子,通过电路中的电子和溶液中的离子的移动而形成回路,传导电流,电子并不进入溶液也不能在溶液中迁移。
⒉ 原电池将一个完整的氧化还原反应分为两个半反应,负极发生氧化反应,正极发生还原反应,一般将两个电极反应中得失电子的数目写为相同,相加便得到总反应方程式。
⒊ 阴离子要移向负极,阳离子要移向正极。这是因为:负极失电子,生成大量阳离子积聚在负极附近,致使该极附近有大量正电荷,所以溶液中的阴离子要移向负极;正极得电子,该极附近的阳离子因得电子生成电中性的物质而使该极附近带负电荷,所以溶液中的阳离子要移向正极。
⒋ 当氧化剂得电子速率与还原剂失电子速率相等时,可逆反应达到化学平衡状态,电流表指针示数为零;当电流表指针往相反方向偏转,暗示电路中电子流向相反,说明化学平衡移动方向相反。
⒌ 不参与电极反应的离子从微观上讲发生移动,但从宏观上讲其在溶液中各区域的浓度基本不变。
⒍ 若有交换膜,离子可选择性通过交换膜,如阳离子交换膜,阳离子可通过交换膜移向正极。
⒎ 若反应为可逆反应,改变条件,平衡移动方向改变时电流方向也改变,正、负极颠倒。
,