- 【看似异常型】
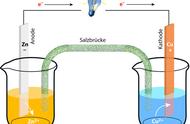
第五类:浓差电池
请先来看下面一道题(部分节选):

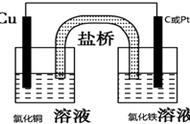
很多同学发现,并不能直接利用金属活泼性判断电池的正负极,因为电池两侧的电池和电解质溶液都是一样的,貌似不存在氧化还原的规律,瞬间感觉此题异常,疑点重重。
但只要认真读题就会捕获到关键信息:“浓差电池”、“银离子浓度越大,氧化性越强”。
具体分析反应过程:根据题干描述,实验开始时,先闭合K1,断开K2,此时为电解池,右侧(B)Ag为阳极,Ag失去电子被氧化生成银离子,同时硝酸根离子通过离子交换膜移向左池,左池中的银离子得到电子变成银单质,最终导致右侧银离子浓度大于左侧,此时两侧银离子形成了浓度差;一段时间后,再断开K1,闭合K2,此时形成浓差电池,右侧银离子浓度更大,根据提示“银离子浓度越大,氧化性越强”,可判断出左侧的银离子将会失电子被氧化,右侧的银离子将会得电子被还原。分析到这里,疑惑就解开了。
- 总结:
原电池题型变来变化去,但基本规律始终是不变的,那就是“剂强物弱”,即氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物“,在做题过程中,只要认真读题,深入进行分析,别想当然地认为怎样怎样,必定可以打破思维定式,突破自己。
,