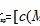沉淀溶解平衡移动、沉淀溶解平衡曲线及分析等是新高考的命题点,归纳典型例题分析:
例一:常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法正确的是( )

A.曲线Ⅱ表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)
FeS(s)+Mn2+(aq)的平衡常数K≈4×105
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿曲线Ⅰ向a点方向移动
答案:D
例二:已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中-lg[c(SO2-4)]、-lg[c(CO2-3)]与-lg[c(Ba2+)]的关系如图所示。

下列说法正确的是( )
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1时,两溶液中c(SO42-)/c(CO32-)=10y2-y1
答案:B
例三:HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)c(H+)为线性关系,如图中实线所示。

下列叙述错误的是( )
A.溶液pH=4时,c(M+)<3.0×10-4 mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
答案:C
例四:用0.100 mol/L AgNO3滴定50.0 mL 0.050 0 mol/L Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.040 0 mol/L Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.050 0 mol/L Br-,反应终点c向b方向移动
答案:C
关注:头条@高中化学教书匠
,