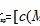今天这节课我们要一起来研究难溶电解质的溶度积,也叫做Ksp。

和我们学过的电离平衡、水解平衡是一样的,沉淀溶解平衡也有自己的平衡常数,它叫做溶度积常数,简称溶度积,符号Ksp。

例如我们常见的这种氯化银沉淀溶解平衡,它的方程式要会书写,重点是标注状态。Ksp其实就是银离子的浓度乘以氯离子的浓度,因为氯化银是一个固体,所以我们在书写公式的时候它是不计入的。
Ksp其实是反映了难溶电解质在水中的一种溶解能力,对于同一难溶电解质来说,Ksp也只和温度有关。一定的温度下啊,如果是相同类型的那种电解质的Ksp越小,代表它溶解度会越小,也就是越难溶解。

影响Ksp的因素除了温度之外,还会有哪些电解质本身的性质?这里我们给大家讲一下,升温,多数的平衡会向溶解的方向移动,Ksp增大。特例啊少数的物质,例如氢氧化钙,它的溶解度其实是随温度升高反倒降低的,Ksp减小,当然这种例子比较少见。

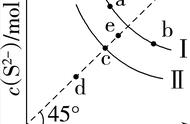
Ksp有什么样的应用呢?比如我们可以根据一定温度下,它的溶度积和溶液当中的离子积,请大家注意这是两个不同的概念,溶度积是ksp,一定指的是平衡状态下,而离子积呢我们可以用符号Q去表示,它是任意时刻的溶液当中离子浓度。
通过比较k和Q的关系,我们大概可以去判断这种温度下溶液当中沉淀或者是溶解的情况。Q大于Ksp代表着溶液当中是有沉淀析出的,等于的时候代表着沉淀和溶解刚好处于平衡的状态,而Q小于Ksp的时候代表着溶液没有达到饱和,它没有沉淀析出。我们在细致地说一下,小于的时候为不饱和状态,等于的时候处于饱和溶液的状态,大于的时候是一个过饱和又沉淀析出的状态。
以上就是关于Ksp的全部讲解,如果有疑问可以在下方留言,也欢迎大家点赞和转发。
,