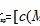学习目标
1.知道难溶电解质的沉淀溶解平衡及其影响因素,能多角度、动态地分析难溶电解质的溶解 平衡。
2.知道溶度积的意义,建立根据溶度积和离子积的大小关系判断反应进行方向的思维模型。
3.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
4.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉 淀转化等实验探究
知识导学
知识点 1 难溶电解质的沉淀溶解平衡
1.25 ℃时,溶解性与溶解度的关系

2.难溶电解质的沉淀溶解平衡
(1)沉淀溶解平衡的建立

(2)沉淀溶解平衡方程式 以 AgCl 沉淀溶解平衡为例:AgCl(s) 溶解 沉淀 Ag+ (aq)+Cl- (aq)
特别提醒 沉淀溶解平衡方程式各物质要标明聚集状态。
(3)沉淀、溶解之间这种动态平衡也决定了 Ag+与 Cl-的反应不能完全进行到底。一般情况下, 当溶液中剩余离子的浓度小于 1×10-5 mol·L -1时,化学上通常认为生成沉淀的反应进行完 全了
3.难溶电解质沉淀溶解平衡的影响因素
(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(3)实例分析
已知沉淀溶解平衡:Mg(OH)2(s) Mg 2+ (aq)+2OH - (aq),请分析当改变下列条件时,对该 沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较)

特别提醒 大多数电解质溶解度随温度的升高而增大,但有许多例外,如 Ca(OH)2,温度越 高,溶解度越小。
例 1.把 Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca 2+ (aq)+2OH - (aq)。 下列说法正确的是( )
A.恒温下向溶液中加入 CaO,溶液的 pH 升高
B.给溶液加热,溶液的 pH 升高
C.向溶液中加入 Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量 NaOH
难溶电解质沉淀溶解平衡与其电离平衡的区别
难溶电解质沉淀溶解平衡表示已溶溶质的离子与未溶溶质之间的平衡,是可逆过程,表达式 需要注明状态,如 Al(OH)3(s) Al3+ (aq)+3OH - (aq)。电离平衡是溶解的弱电解质分子 与离子之间的转化达到的平衡状态,难溶强电解质的电离,没有电离平衡,如 BaSO4===Ba 2 ++SO2- 4 ;难溶弱电解质的电离,存在电离平衡,如 Al(OH)3 Al3++3OH -。
知识点 2 溶度积常数
1.概念 难溶电解质的沉淀溶解平衡常数称为溶度积常数,简称溶度积,符号为 Ksp,Ksp的大小反映 难溶电解质在水中的溶解能力。
2.表达式