2020高考必备高中《有机化学基础》知识点总结
一、重要的物理性质
1.有机物的溶解性
(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
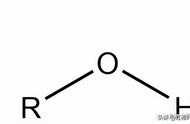
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。
二、重要的反应
1.能使溴水(Br2/H2O)褪色的物质
(1)有机物① 通过加成反应使之褪色:含有
、—C≡C—的不饱和化合物
② 通过取代反应使之褪色:酚类 注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。③ 通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色 ④ 通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯
(2)无机物① 通过与碱发生歧化反应 3Br2 6OH- == 5Br- BrO3- 3H2O或Br2 2OH- == Br- BrO- H2O
② 与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2
2.能使酸性高锰酸钾溶液KMnO4/H 褪色的物质
1)有机物:含有
、—C≡C—、—OH(较慢)、—CHO的物质 苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应)
2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2
3.与Na反应的有机物:含有—OH、—COOH的有机物
‚与NaOH反应的有机物:常温下,易与—COOH的有机物反应加热时,能与卤代烃、酯反应(取代反应)
ƒ与Na2CO3反应的有机物:含有—COOH的有机物反应生成羧酸钠和苯酚,并放出CO2气体;
④与NaHCO3反应的有机物:含有—COOH的有机物反应生成羧酸钠并放出等物质的量的CO2气体。
4.既能与强酸,又能与强碱反应的物质
(1)氨基酸,如甘氨酸等
H2NCH2COOH HCl → HOOCCH2NH3Cl
H2NCH2COOH NaOH → H2NCH2COONa H2O
(2)蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH和呈碱性的—NH2,故蛋白质仍能与碱和酸反应。
5.银镜反应的有机物
(1)发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等)
(2)银氨溶液[Ag(NH3)2OH](多伦试剂)的配制:
向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。
(3)反应条件:碱性、水浴加热 酸性条件下,则有Ag(NH3)2 OH - 3H == Ag 2NH4 H2O而被破坏。
(4)实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出
(5)有关反应方程式:AgNO3 NH3·H2O == AgOH↓ NH4NO3 AgOH 2NH3·H2O == Ag(NH3)2OH 2H2O
银镜反应的一般通式: RCHO 2Ag(NH3)2OH
2 Ag↓ RCOONH4 3NH3 H2O
【记忆诀窍】: 1—酸(RCOONH4 )、2—银、3—氨
甲醛(相当于两个醛基):HCHO 4Ag(NH3)2OH
4Ag↓ (NH4)2CO3 6NH3 2H2O
乙二醛: OHC-CHO 4Ag(NH3)2OH
4Ag↓ (NH4)2C2O4 6NH3 2H2O
甲酸: HCOOH 2 Ag(NH3)2OH
2 Ag↓ (NH4)2CO3 2NH3 H2O
葡萄糖:(过量)CH2OH(CHOH)4CHO 2Ag(NH3)2OH
2Ag↓ CH2OH(CHOH)4COONH4 3NH3 H2O
(6)定量关系:—CHO~2Ag(NH)2OH~2 Ag HCHO~4Ag(NH)2OH~4 Ag
6.与新制Cu(OH)2悬浊液(斐林试剂)的反应
(1)有机物:羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽糖)、甘油等多羟基化合物。
(2)斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液(即斐林试剂)。
(3)反应条件:碱过量、加热煮沸
(4)实验现象:
① 若有机物只有官能团醛基(—CHO),则滴入新制的氢氧化铜悬浊液中,常温时无变化,加热煮沸后有(砖)红色沉淀生成; ② 若有机物为多羟基醛(如葡萄糖),则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有(砖)红色沉淀生成;
(5)有关反应方程式:2NaOH CuSO4 == Cu(OH)2↓ Na2SO4
RCHO 2Cu(OH)2
RCOOH Cu2O↓ 2H2O
HCHO 4Cu(OH)2
CO2 2Cu2O↓ 5H2O
OHC-CHO 4Cu(OH)2
HOOC-COOH 2Cu2O↓ 4H2O
HCOOH 2Cu(OH)2
CO2 Cu2O↓ 3H2O
CH2OH(CHOH)4CHO 2Cu(OH)2
CH2OH(CHOH)4COOH Cu2O↓ 2H2O
(6)定量关系:—COOH~½ Cu(OH)2~½ Cu2 (酸使不溶性的碱溶解)
—CHO~2Cu(OH)2~Cu2O HCHO~4Cu(OH)2~2Cu2O