化学反应的能量一般不足以引起原子核的变化,因此对原子结构的研究主要集中在原子核外电子的行为即原子核外电子的运动状态和变化规律上。电子很小、运动速度很快,不能利用研究宏观物体运动的方法对其进行研究。那么科学家是如何认识和研究核外电子的呢?
对原子结构的认识
19世纪,英国物理学家道尔顿(J. Dalton,1766—1844)提出了近代原子论,认为原子有质量,不可分割,但该理论无法解释很多事实。19世纪末,英国物理学家汤姆生(J. J. Thomson,1856—1940)发现了电子,提出电子普遍存在于原子中。
1911年,英国物理学家卢瑟福(E. Rutherford,1871—1937)根据α粒子散射实验修正了汤姆生的“葡萄干面包式”原子结构模型,提出了原子结构的有核模型。卢瑟福认为原子的质量主要集中于原子核上,电子在原子核外空间做高速运动。由于对原子结构研究的贡献,卢瑟福被称为“原子之父”“原子核物理学之父”。
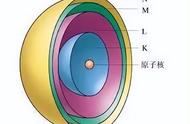
1913年,丹麦物理学家玻尔(N. Bohr,1885—1962)研究了氢原子的光谱后,根据量子力学的观点,大胆突破传统思想的束缚,提出了新的原子结构模型:(1)原子核外电子在一系列稳定的轨道上运动,这些轨道称为原子轨道。核外电子在原子轨道上运动时既不放出能量,也不吸收能量。 (2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的,即量子化的。(3)原子核外电子可以在能量不同的轨道上跃迁。 电子吸收了能量(如光能、热能等)后就会从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,同时发出光子,发出光的波长取决于两个轨道的能量之差。