用统计图示的方法来形象地描绘电子在原子核外空间出现机会的大小。用小点代表电子在核外空间区域出现的机会,小点疏密与出现机会成正比。由此得到的图形叫电子云(electron cloud)。(其他表示方法见上)
经过一个世纪的探索,科学家已经揭开了原子结构的面纱,但尚未完全阐明核外电子运动的能量和化学反应的关系,现有点理论还需要修正和完善。
原子核外电子的运动特征
不同元素的原子所含有的电子数是不同的。在含有多个电子的原子中,电子在核外的运动状态是否相同?各个电子具有的能量是否一样?
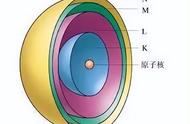
在含有多个核外电子的原子中,电子的能量往往是不同的。根据电子能量差异和主要运动区域的不同,核外电子处于不同的电子层(electron shell)上。习惯上用字母n表示电子层。原子中由内向外的电子层数n可依次取1、2、3、4等正整数,对应的电子层符号分别为K、L、M、N、O等。
实验和量子力学研究表明,处于同一电子层的原子核外电子,可以在不同类型的原子轨道(不同于玻尔提出的原子轨道,是指量子力学描述电子在原子核外空间运动的主要区域)上运动,其能量也不相同,故可将同一电子层进一步划分为不同能级。轨道的类型不同,能量不同,形状也不同。常用小写英文字母s、p、d、f 分别表示不同形状的轨道。

s轨道和p轨道的示意图
s轨道呈球形(球形对称);p轨道呈纺锤形(纺锤形对称),有x、y、z三个伸展方向(三个轨道);d轨道有五个伸展方向(五个轨道),呈花瓣形;f轨道有七个伸展方向(七个轨道),形状更为复杂。原子轨道的形状是将这个能级上的电子在核外出现频率P=90%的空间圈出来所得的电子云轮廓图。

d轨道示意图
形状相同的原子轨道在原子核外空间还有不同的伸展方向。s轨道是球形对称的,所以s轨道只有1个轨道;p轨道在空间有x、y、z 3个伸展方向,所以p轨道包括px、py、pz 3个轨道。
为了表明原子核外电子所处的轨道,将表示电子层的n和表示原子轨道的s、p、d、f结合起来表示原子轨道,如1s、2s、2p、3d等。各原子层包含的原子轨道数目和可容纳的电子数如表所示。