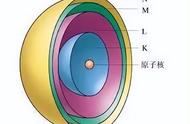
原子中的电子可处于许多不同的运动状态,每一状态都具有一定能量,在一定条件下,分布在各个能级上的原子数是一定的,大多数原子都处于能量最低的状态,即基态。当原子受到电弧或电火花等外来作用时,可以由能量较低的状态跃迁到能量较高的状态,这称为激发态。但跃迁到高能级E2的原子是不稳定的,约10~10S后,便要跃迁到某一低能级E1,并伴随着发出能量为△E=E2—E1的光子。根据公式E=hv,可得到发出光子的频率。用底片将此接收下来,便得到一条谱线。与此同时还有其他原子要发生其他能级间的跃迁,伴随着这些跃迁还要发出其他频率的光来。将这些不同频率的光通过棱镜就得到一系列亮的条纹,称为原子发射光谱。若将一白光通过一物质,则物质中的原子将吸收其中某些频率的光而从低能级跃迁到高能级。这样,白光通过棱镜后将出现一系列暗的条纹,这样获得的光谱称为原子吸收光谱。不同元素的原子中电子发生跃迁时吸收或放出的光是不同的,可以用光谱仪摄取各种元素原子的发射光谱或吸收光谱。


原子吸收光谱仪

原子吸收光谱仪
原子光谱包括原子发射光谱,原子吸收光谱,原子荧光光谱,X射线荧光光谱以及原子质谱五种原子光谱。在现代化学中,可通过原子发射光谱或吸收光等来检测元素,称为光谱分析。许多元素是通过原子光谱分析发现的,如稀有气体氦(其拉丁文原意是“太阳元素”)就是1868年分析太阳光谱时发现的。
金属的焰色反应
焰色反应是某些金属或它们的挥发性化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,有些金属或其化合物在灼烧时能使火焰呈特殊颜色。这是因为这些金属元素的原子在吸收火焰提供的能量时,其外层电子将会被激发到能量较高的激发态。处于激发态的外层电子不稳定,又要跃迁到能量较低的基态。不同元素原子的外层电子具有着不同能量的基态和激发态,在跃迁过程中就会产生不同波长的电磁波,如果这种电磁波的波长在可见光波长范围内,就可在火焰中观察到这种元素的特征焰色。利用元素的这一性质就可以检验一些金属或金属化合物的存在,这就是物质检验中的焰色反应(是利用稀薄气体或金属蒸气发射光谱),它利用的是原子发射光谱。发射光谱由于亮线暗背景的特点又叫明线光谱,因其由游离状态的原子发射的,也叫原子光谱,其谱线也叫原子的特征谱线。