生物化学复习提纲
第一章 蛋白质化学
1. 简述蛋白质的功能:
1 催化功能-酶
2 调控功能-激素、基因调控因子
3 贮存功能-乳、蛋、谷蛋白
4 转运功能-膜转运蛋白、血红/血清蛋白
5 运动功能-鞭毛、肌肉蛋白
6 结构成分-皮、毛、骨、牙、细胞骨架
7 支架作用-接头蛋白
8 防御功能-免疫球蛋白
2. 蛋白质含氮量16%,凯氏定氮法;
蛋白质含量 = 每克样品中含氮的克数×6.25
凯氏定氮法
蛋白质与硫酸和催化剂一同加热消化,分解氨与硫酸结合。然后碱化蒸馏使氨游离,用硼酸吸收后再以酸滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量
3. 酸性氨基酸,碱性氨基酸,芳香族氨基酸,亚氨基酸,含硫氨基酸,含羟基氨基酸?
酸性氨基酸: Asp、 Glu
碱性氨基酸:Arg、Lys、His,另外还有:羟赖氨酸(Hyl)、羟脯氨酸(Hyp)、胱氨酸
芳香族氨基酸:Phe、Try、Tyr
亚氨基酸:Pro
含硫氨基酸:Cys、Met
含羟基氨基酸:Ser、Thr
4. 必需氨基酸,非必需氨基酸;
必需氨基酸:异亮氨酸(Iso)、亮氨酸(Leu)、赖氨酸(Lys)、蛋氨酸(Meth)、苯丙氨酸(Phe)、苏氨酸(Thre)、色氨酸(Try)和缬氨酸(Viline)
非必需氨基酸:
5. 手性和比旋光度的偏转方向是否有一致性?;
AA的手性D,L与比旋光度的偏转方向并没有一致性。
6. 具有近紫外光吸收的氨基酸;
Tyr/Trp/Phe
7. 氨基酸的等电点;
①当溶液为某一pH值时,AA主要以兼性离子的形式存在,分子中所含的正负电荷数目正好相等,净电荷为0。这一pH值即为AA的等电点(pI)。
②在pI时,AA在电场中既不向正极也不向负极移动,即处于两性离子状态。
8;蛋白质的一级结构;
蛋白质多肽链的氨基酸排列顺序——蛋白质的一级结构
9、肽键中C-N键的性质及肽平面;
肽键中C-N键有部分双键性质——不能⾃由旋转
组成肽键原⼦处于同⼀平⾯(肽平⾯)
10.什么是蛋白质的二级结构,常见的二级结构有哪些,它们有什么特点?;
⑴①指肽链的主链在空间的排列,或规则的⼏何⾛向、旋转及折叠。
②只涉及主链构象⽽不涉及残基侧链③维系⼆级结构的化学键是氢键⑵α-螺旋、 β-折叠、 β-转⻆、⽆规卷曲
⑶α-螺旋的特点:
β-折叠的特点:■ Cα 总是处于折叠的⻆上
■ AA的R基团处于折叠的棱⻆上并与之垂直
■两个AA之间的轴⼼距为0.35nm
■氢键主要在链间/同⼀肽链不同部分间形成
■⼏乎所有肽键都参与链内氢键的交联
■氢键与链的⻓轴接近垂直
β-转⻆的特点:■由4个连续的AA残基组成
■第⼀个残基C=O
■第四个残基NH
■这类结构主要存在于球状蛋⽩分⼦中。
⽆规卷曲的特点:
11、角蛋白主要是什么二级结构,化学烫发是否有二硫键的断开和生成?角蛋白主要是什么二级结构?
⑴角蛋白是纤维状蛋⽩质
⑵化学烫发是有二硫键的断开,无生成
12.什么是蛋白质的三级结构,稳定三级结构的作用力有哪些?
⑴■在⼆级结构基础上
■包括主链和侧链构象在内的三维结构(主要指球状蛋⽩)
⑵稳定蛋⽩质三级结构的作⽤⼒
■ 氢键
■ 范德华⼒
■ 疏⽔作⽤
■ 离⼦键
■ 配位键
■ ⼆硫键
13.四级结构及亚基
蛋白质四级结构:指由多条各⾃具有⼀、⼆、三级结构的肽链通过⾮共价键连接起来的结构形式。
亚基:①种类、数⽬、空间排列⽅式
②亚基间的相互作⽤关系
14.什么叫分子病;举一个分子病的例子。
分⼦病:由于基因突变,导致蛋⽩质中氨基酸种类发⽣变化,并引起功能降低或丧失。
例:镰⼑型贫⾎症
15.蛋白质的等电点;
pI通常在 6.0 左右
等电点:在某⼀pH值的溶液中,蛋⽩质分⼦上所带的正、负电荷数量相等, 净电荷为零,在电场中既不移向正极也不移向负极,此时溶液pH值就是该蛋⽩质的等电点。在等电点时,蛋⽩质的溶解度最低。
16.蛋白质胶体溶液的稳定因素?
①同种蛋⽩带同种电荷,相互排斥
②弹性⽔化膜
17.蛋白质变性的定义,变性蛋白质的特征?
⑴蛋⽩质变性:某些理化因素破坏天然Pr结构状态,引起Pr理化性质改变、⽣物学功能改变或丧失的现象 。
⑵变性蛋⽩质的特点:
A.⽣物活性丧失
B.疏⽔基外露、溶解度降低、粘度增⼤
C.侧链基团暴露:
——易与化学试剂反应、光学性质变化
D.⽣化性质改变:结构伸展易被酶解
18. 葡聚糖凝胶色谱时,蛋白质大分子先洗脱还是小分子先洗脱?SDS-PAGE中,蛋白质大分子电泳速度快还是小分子电泳速度快?
⑴蛋白质大分子先洗脱
⑵小分子游的快
第二章 核酸化学
1. 证明核酸是遗传物质的经典实验是。。。;
1928年 Grifths(英国)的肺炎双球菌转化实验——证实核酸作为遗传物质
2. 组成RNA和组成DNA的核苷酸有什么差异?
RNA:A、G、C 、U
DNA:A、G、C、T
3. 嘌呤核苷和嘧啶核苷的C-N糖苷键中C和N的编号分别是多少?
4. DNA二级结构中Watson和Crick阐明的二级结构有什么特征?
1 其他组合易相互排斥。因此,DNA的双股系藉着A:T和G : C的配对关系互相结 合 。
2 DNA,双螺旋,正反向,互补链。
3 碱基力和氢键,维持螺旋结构坚。
4 A对T,GC连,配对时,靠氢键, AT2,GC3,十碱基,转一圈,螺距34点中间。
5. RNA的主要种类有哪些?哪种含量最多,哪种稀有碱基含量最高?
RNA的主要种类是rRNA、tRNA、 mRNA,其中tRNA所占比例最高达到80%
6. tRNA的二级结构和三级结构分别是什么形状?
tRNA的三叶草型二级结构
7.什么是核酸的变性和复性,什么是增色效应和减色效应?
核酸的变性:DNA双螺旋二级结构的破坏
增色效应:由于变性或降解引起紫外吸收增加的现象
核酸的复性:变性DNA在适当的条件下,两条彼此分开的单链重新缔合成双链
减色效应(低色效应):性时紫外吸收减少
8.变性因素有哪些
高温(一般>75℃)、强氧化剂、强酸、碱、尿素等;
变性机理是什么?
机理:双链间氢键断开,成为两条单链;
8.什么是Tm值?
引起DNA变性的温度称为熔点——Tm
9. 核酸含量的测定的方法有哪些?
紫外吸收法、定糖法、定磷法、琼脂糖凝胶电泳
10. 核酸的紫外吸收主要是因为核酸中的那种成分?
碱基含有共轭双键,最大吸收波长260nm
第三章 酶
1. 什么是单纯酶,结合酶,辅助因子分为哪两类,如何区分?什么是核酶?
单纯酶 :只有蛋白质
结合酶: 酶蛋白 辅助因子
辅助因子:①辅基——与酶结合紧
②辅酶——与酶结合松
2. 与一般催化剂相比,酶的催化有什么特点?
① 只能催化热力学上允许的反应。提高反应速度,不改变平衡点;
② 只起催化作用,本身不消耗;
③ 降低反应的活化能,但是不改变反应前后自由能差
②具有高度的专一性
1.绝对专一性;2.基团专一性;3.键专一性;4.立体异构专一性
3. 国际酶学委员会将酶分为6大类,依次是:。。。?
①氧化还原酶类
②转移酶类
③水解酶类
④裂解酶类
⑤异构酶类
⑥合成酶类
4. 影响酶作用的因素有哪些?
1 底物浓度
2 温度
3 pH
4 酶浓度
5 激活剂
6 抑制剂
5. 写出米氏方程,并能用米氏方程进行底物浓度和反应速度的计算。
V=Vmax【S】/Km 【S】
【S】:底物浓度
V:不同【S】时的反应速度
Vmax:最大反应速度
Km:米氏常数
6. 米氏常数的物理含义是什么?是酶的特征常数吗?Km最大还是最小是最适底物?
⑴Km的物理含义:当反应速度为最大反应速度一半时,Vmax/2=Vmax【S】/Km 【S】
⑵Km是酶的特性常数:与pH 、温度、离子强度、酶及底物种类有关,
与酶浓度无关,可以鉴定酶。
⑶Km越小,亲和力越强。[S]很小时,反应速度就能达到很大。性能优,代谢中这类酶更为重要
7. 酶的可逆抑制作用有哪几类,它们的动力学有什么特点?
⑴酶的抑制作用分为:①失活作用:使酶Pr变性而引起酶活力丧失
②抑制作用:使酶活力下降但不引起变性
③抑制剂:能引起抑制作用的物质
⑵动力学特点:—作用于酶的必需基团/活性中心基团
—使其化学性质改变
—酶活力降低或丧失
8. 酶的不可逆抑制剂一般都有剧毒,举几个例子。
重金属、有机磷、有机汞、有机砷、氰化物、青霉素,毒鼠强等。
9. 什么是酶的活性部位(活性中心)可分为哪两个部位?
①结合中心:与S结合;决定酶促反应的专一性
②催化中心:促进S发生化学变化;决定酶促反应的性质
10. 什么是酶的必需基团,必需基团是否必需在活性中心?
酶的必需基团是与酶的催化活性直接相关的化学基团。
必需基团:①位在活性中心
②活性中心以外,稳定分子构象
11. 决定酶作用高效率的机制有哪些?
1 邻近效应与定向效应
2 电子张力与变形
3 酸碱催化
4 共价催化
5 微环境效应
12.什么是别构调控,别构酶有什么特点?12. 最常见的共价修饰是哪种?
变构(别构)调控:蛋白质在实现生物功能时,构象发生变化、活力改变的现象。
变构酶的特点:①多亚基寡聚酶
②有活性中心、变构调节中心
③多数有多个活性中心,有同促效应;有的不止一个别构中心。
④不遵循米氏方程
共价修饰,主要是指p53蛋白的磷酸化与去磷酸化及乙酞化与去乙酞化。
13. 酶原存在的生物学意义?
·保护自身组织不被水解
·机体调控的一种形式
14. 什么是维生素,根据溶解性分成哪两类?
维生素是机体维持正常生命活动所必不可少的一类小分子有机物质。
根据溶解性分为脂溶性与水溶性。
15. 了解哪种维生素是哪种辅酶的成分,了解缺乏维生素可能出现的疾病。
维生素A:夜盲症、干眼病、皮肤燥
维生素D:佝偻病、软骨病、严重蛀牙、骨质疏松
维生素B1:辅酶是TPP。脚气病、消化功能障碍
维生素B2:辅酶是 FMN/FAD 。唇炎、舌炎、口角炎、角膜炎
VB3:以辅酶A存在,
VPP:辅酶是NAD 和NADP 。癞皮症
VB6:辅酶是磷酸吡哆醛。小红细胞低色素性贫血、导致皮肤、中枢神经系统和造血机构的损害。
VB12:辅酶是脱氧腺苷钴胺素。 儿童及幼龄动物发育不良、消化道上皮组织细胞失常、造血器官功能失常,导致恶性贫血、髓磷脂的生物合成减少,损害神经系统
VB7(生物素):皮炎、肌肉疼痛、感觉过敏、怠倦、厌食、轻度贫血等
VC:坏血症
维生素K:出血症
维生素E:生殖器官受损而不育、死胎、细胞异型
第四章 生物氧化
1. 生物氧化中,CO2主要是怎么产生的?H2O是怎么产生的?
CO2如何生成?——脱羧反应
H2O如何生成?——电子传递链
能量如何生成?——ATP的生成
2. 什么是呼吸链?
代谢物脱下的氢(电子)通过多种酶和辅酶所催化的连锁反应逐步传递,最终与氧结合生成水,这一系列酶和辅酶称为呼吸链又称电子传递链
3. 线粒体中主要的两条呼吸链的传递体组成。
· NADH氧化呼吸链
——细胞内主要的呼吸链
· FADH2氧化呼吸链
由琥珀酸脱氢酶复合体、CoQ和Cyt组成
4. 什么是氧化磷酸化?
氧化磷酸化 是指在呼吸链电子传递过程中偶联ADP磷酸化,生成ATP,又称为偶联磷酸化。主要在线粒体内膜进行。
5. 化学渗透学说的主要内容?
a. 线粒体内膜的电子传递链是一个质子泵
b. 电子由高能状态传递到低能状态时释放出来的能量,用于驱动膜内侧的H 迁移到膜外侧(内膜对H 是不通透的),在膜内外侧产生了跨膜质子梯度 和电位梯度
6. 氧化磷酸化的解偶联剂和电子传递链的抑制剂有哪些?
二硝基苯酚;解偶联蛋白。
寡霉素
7. 什么是P/O值(磷氧值),NADH和FADH2的磷氧值分别是多少?
呼吸过程中无机磷酸(Pi)消耗量和氧消耗量的比值称为磷氧比。
实测得NADH呼吸链: P/O~ 2.5
实测得FADH2呼吸链: P/O~ 1.5
8. NADH穿梭进入线粒体的有哪两种途径?有什么特点
NADH不能穿过线粒体内膜
1、甘油-3-磷酸穿梭途径
(动物骨骼肌、脑及昆虫的飞翔肌等组织细胞中)
2、苹果酸-天冬氨酸穿梭途径
(心脏、肝脏细胞)
第五章 糖代谢
1. 什么是糖酵解?
无氧参与的条件下,1葡萄糖分解产生2丙酮酸,并伴随ATP生成的过程。
2. 糖酵解的反应历程。
Glucose 2 ADP 2Pi 2NAD 2 pyruvate 2ATP 2H2O 2NADH 2H
3. 1分子葡萄糖经过糖酵解产生的ATP数量。
1G → 2ATP 2NADH 2H 2丙酮酸 =2 2×2.5=7ATP
4.糖酵解的关键酶有哪几个?
己糖激酶、葡萄糖激酶(只存在肝脏)、磷酸葡萄糖异构酶、磷酸果糖激酶-1、醛缩酶、丙酮酸激酶
4.厌氧运动产生乳酸,另外,厌氧生物发酵可将丙酮酸生成乳酸或乙醇。
4.糖酵解的生理意义?
1 为机体提供ATP
2 作为细胞内其它物质合成的原料
6.三羧酸循环的反应历程;
7.三羧酸循环的生理学意义;
1 是好氧生物体内最主要的产能途径!
2 是脂类、蛋白质彻底分解的共同途径!
3 某些中间产物可作为别构效应物
4 提供合成其他化合物的碳骨架
9. 三羧酸循环的特征;
①有两个C原子进入循环,也有两个C原子离开循环,但离开的两个并不直接是进入的两个。
②有四对氢原子离开循环,进入呼吸链进一步氧化成水生成ATP
③有一步底物水平磷酸化直接产生ATP/GTP
④有两个水分子被消耗
⑤氧气并不直接参与循环,但氧气的存在是TCA循环进行所必需的
10.三羧酸循环的关键酶;
柠檬酸合酶、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶
10.体内的五碳糖和七碳糖是由哪个途径产生
12. 什么是糖异生?糖异生是糖酵解的简单逆过程吗?糖异生的生理意义是?
糖异生作用——非糖(乳酸、甘油、丙酮酸、草酰乙酸、生糖氨基酸) 物质合成葡萄糖。
糖异生的生理意义:①饥饿状态下维持血糖浓度恒定
②回收乳酸能量,补充肝糖原
③调节酸碱平衡
第六章 脂代谢
1. 甘油的代谢与糖酵解之间的联系;
2. 脂肪酸的活化需要消耗几个高能磷酸键?10碳以上的脂酰CoA是通过什么转运进入线粒体?
脂肪酸的活化需要消耗1个ATP的2个高能磷酸键
10碳以上的脂酰CoA只能透过线粒体外膜,但不能透过线粒体内膜
3. 什么是脂肪酸的氧化,饱和脂肪酸每轮氧化有几个什么类型的反应?不饱和脂肪酸是否能进行氧化?氧化的生理意义是什么?
脂肪酸-氧化的生理意义:①为机体提供比糖氧化更多的能量
②乙酰CoA还可作为脂肪酸和某些AA的合成原料
③产生大量的水可供陆生动物对水的需要
4.如何计算不同碳原子长度的饱和脂肪酸彻底氧化产生多少ATP?计算的依据?

5. 什么是酮体?酮体的生成和利用有什么特点?
乙酰CoA可在肝细胞形成乙酰乙酸、β-羟丁酸、丙酮,这三种物质统称为酮体。
特点:①酮体是脂肪酸在肝脏内的正常中间代谢产物
②但肝脏没有乙酰乙酸-琥珀酰CoA转移酶
③酮体易溶于水,透出细胞进入血液循环
④在肝外组织进行氧化
——肝内生成和肝外利用
⑤是肝脏输出能源的形式,主要供应肌肉和脑。
⑥但是酮体主要为酸性物质,大量累积产生酸中毒,破坏机体水盐代谢平衡
6. 脂肪酸合成的原料有哪些?合成的部位是哪里?每轮有几个什么类型的反应?
原料:乙酰CoA和丙二酸单酰CoA(源于乙酰CoA)
场所:细胞溶胶
7. 什么是必需脂肪酸?为什么哺乳动物不能合成必需脂肪酸?
必需脂肪酸是指人体必需,自身不能合成,需要从食物中获得的脂肪酸。包括亚油酸(C18:2)和α-亚麻酸(C18:3)
因为动物体内没有异柠檬酸裂解酶和苹果酸合酶
第七章 氨基酸代谢
1. 体内蛋白质降解的两个途径是什么?
溶酶体途径、蛋白酶途径
氨基酸脱氨基反应有哪三种形式?氧化脱氨基主要酶是哪个?
氧化脱氨基的主要酶是谷丙转氨酶,谷草转氨酶
氨基酸脱氨基反应方式

3. 氨的来源有哪些?不同生物是如何排泄氨?
氨的来源:①血氨的来源
Amino Acid 脱氨基(Deamination)
肠道细菌的腐败作用与尿素(Urea)的分解
肾小管上皮分泌—Gln的分解
②血氨的去路
在肝脏合成 尿素
合成谷氨酰胺
合成非必需氨基酸
氨的排泄:①合成非必需氨基酸,并参与嘌呤、嘧啶等含氮化合物的合成
②形成无毒的谷氨酰胺(Gln)
③ 转变成尿酸(禽类)、尿素(哺乳动物)
4. 尿素循环的特点?其中哪些氨基酸不是合成蛋白质的氨基酸?
限速酶:精氨酸代琥珀酸合成酶
耗能过程:3ATP中4个高能键
三个氨基酸:鸟氨酸,瓜氨酸,精氨酸
N与C来源:氨基酸脱氨和CO2
生成1分子尿素,消除2分子氨和1分子CO2
5. 生糖氨基酸,生酮氨基酸,生糖兼生酮氨基酸分别有哪些?
生酮氨基酸——亮氨酸
生糖氨基酸——所有非必需氨基酸 精氨酸和组氨酸
生糖兼生酮氨基酸:异亮氨酸 、色氨酸、苯丙氨酸、赖氨酸 、酪氨酸
6. 氨基酸合成有几种类型?
第八章 核酸代谢
1.嘌呤分解的最终产物是什么?尿酸的代谢异常会产生什么病?临床上用什么药物治疗?
嘌呤的分解代谢终产物:人、猿以及鸟类、爬虫类和大多数昆虫——尿酸
其他哺乳动物、双翅目昆虫——尿囊素
硬骨鱼类——尿囊酸
大多数鱼类、两栖类——尿素

2.嘧啶的分解主要生成物质是什么?
β-氨基酸
3. 嘧啶和嘌呤从头合成的碳骨架的原子的来源是什么?
CO2
4. 嘌呤核苷酸和嘧啶核苷酸从头合成的异同?
在嘌呤核苷酸中,嘌呤碱以第9位的N与戊糖第1'位的C以核苷键相连接;戊糖第5'位的C再与磷酸以脂键相结合.而嘧啶核苷酸中,则是嘧啶碱以第1位的N与戊糖第1'位的C以核苷键相连接,其它不变。
第九章 DNA的生物合成
1. DNA复制的特点是什么?其中什么是半保留复制,什么是半不连续复制?
DNA复制的特点:①DNA复制是半保留复制
②DNA复制具有固定的起点
③DNA复制多为双向复制,少数为单向复制
④DNA复制的方向始终是5'-3'
⑤DNA复制需要引物
⑥DNA半不连续复制
⑦DNA复制具有高度的忠实性
半保留复制:在复制过程中,首先亲代双链解开,然后每条链作为模板,按照碱基配对原则合成互补的子代链。每个子代DNA分子中有一条链完全来自亲代DNA,另一条是新合成的。
半不连续复制是指DNA复制时,前导链上DNA的合成是连续的,后随链上是不连续的,故称为半不连续复制。
2. 什么是冈崎片段?冈崎片段——DNA合成是不连续的,先合成一些DNA小片段,其大小h含1000-2000个核苷酸残基,然后再通过DNA连接酶将它连接起来。
2.参与DNA复制的酶和蛋白因子主要有哪些? 大肠杆菌的DNA聚合酶有几种?哪种主要负责合成基因组DNA?
参与DNA复制的酶和蛋白因子:DNA聚合酶、DNA连接酶、拓扑异构酶、DNA解链酶、单链结合蛋白、引发酶
大肠杆菌的DNA聚合酶:DNA聚合酶I、DNA聚合酶Ⅱ、DNA聚合酶III
4. DNA受紫外线照射容易产生什么二聚体?DNA损伤修复的种类有哪些?
当DNA受到大剂量紫外线(波长260nm附近)照射时,可引起DNA链上相邻的两个嘧啶碱基共价聚合,形成二聚体,例如TT二聚体。
DNA损伤修复的种类:①直接复活——a.光复活修复
b.暗修复
②切除修复
③错配修复
④*修复
⑤SOS修复
第十章 RNA的生物合成
1. 什么是转录?什么是模板链,反义链,什么是编码链,有义链?
转录:以DNA单链为模板,NTP为原料,在DNA依赖的RNA聚合酶催化下合成RNA链的过程。
反意义链:以该链中的DNA碱基顺序指导RNA的合成即被转录的那条DNA链。有意义链:不被转录的那条DNA链,但其碱基顺序除T代替U外,其余与mRNA相同。
模板链:可作为模板转录为RNA的那条链,该链与转录的RNA碱基互补(A-U,G-C)。
2. 转录的基本特征是什么?
1 转录发生在DNA分子的特定区域
2 以四种核糖核苷三磷酸为底物,需要Mg 2
3 需要模板和DNA的解链
4 第一个被转录的核苷酸通常是嘌呤核苷酸
5 转录方向也是5'-3'
6 转录有高度的忠实性
7 转录受到严格调控
3. DNA复制与转录的异同?

4. 什么是不对称转录?
不对称转录:DNA双链上,仅一股链转录,另一股不转录。5. 大肠杆菌RNA聚合酶的亚基主要功能?真核细胞的RNA聚合酶有哪些种类,它们有什么特点?
RNA聚合酶的亚基主要功能:
①σ—识别DNA链上合成RNA的起始信号,开始合成RNA链时,必须有σ因子,一旦合成开始以 后, σ因子释放出来。
②β'—参与酶与底物的结合,以及与σ因子和核心 酶的结合。
③β —参与σ因子和核心酶的结合,并参与RNA合成的引发、
延伸。
④α —与模板的结合、酶的滑动以及碱基识别有关

6. 真核生物mRNA加工的步骤?
①加帽
②加尾
③甲基化
④内含子剪接
第十一章 蛋白质的生物合成
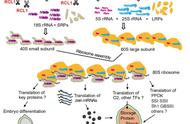
1.原核和真核生物核糖体及其大小亚基的沉降系数分别是多少?
真核细胞核糖体大亚基沉降系数为60S,小亚基沉降系数为40S
2. 起始tRNA在原核和真核生物中有什么区别?
原核细胞:起始甲酰甲硫氨酰tRNA—tRNAfMet
真核细胞:起始tRNA—tRNAiMet
肽链延伸—tRNAeMet
3. 密码子的特征是什么?只有一个密码的氨基酸有哪些?起始密码子和终止密码子有哪些?
密码子的特征:①密码子不重叠
②密码子的通用性
③密码的兼(简)并性
④密码子的连续性
⑤密码子的摆动性
只有一个密码子的氨基酸:甲硫氨酸(Met)、色氨酸(Trp)
起始密码子为AUG(甲硫氨酸) GUG(缬氨酸),
终止密码子为UAA、UAG、UGA
4. 什么是S D序列?什么是多核糖体?肽链合成的方向是什么?
S D序列:位于起始位点上游4-13个核苷酸——AAGGAGGU
多核糖体:把细胞放在极其温和的条件下处理,就能得到几个到几十个核糖体在一条mRNA上结合起来的形态。
肽链合成方向N → C
,