2.需要注意的点
(1)F没有正价;O除氟化物外,一般不显正价;金属元素一般无负价。主族元素最高正价=最外层电子数=族序数;主族元素最低负价=最外层电子数-8=族序数-8。
(2)非金属性的正价有多种,一般是由共用电子对的偏移形成的。简单的阴离子的价态均是最低负价,如S2-、Cl-、P3-等。所以我们在用化合价判断元素在周期表中位置时,一定要分清是否为最高正价和最低负价,如某主族元素R的化合物为Na2R、RO2,则R在元素周期表中的位置为_________。
此题就不能用RO2中R的 4价来确定R在元素周期表中的位置,因为不能确定RO2中R的 4价是最高正价。
3.由原子序数确定元素位置
例如:84号元素、88号元素在周期表中的位置
首先确定零族元素的原子序数,方法:每一周期所容纳的元素种类为2、8、8、18、18、32、32,计算出与84比较接近的零族元素的原子序数,第6周期零族元素是86号元素,然后84与86比较得出结论,84号元素是第六周期ⅥA族;同理88号元素是第七周期ⅡA族。
04

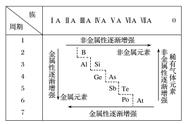
考点4 元素的“位─构─性”之间的关系
(如下图所示)

方法点击
本考点是无机化学的核心知识,因此是高考中每年必考的重点知识。在复习中一定要抓住元素的“位─构─性”之间的关系,掌握一点来推测另两点。
05

考点5 电子数相同的粒子
1.核外电子总数为2的粒子:He、H-、Li 、Be2 。
2.核外电子总数为10的粒子
①分子:CH4、NH3、H2O、HF、Ne。
②阳离子:Na 、Mg2 、Al3 、NH4 、H3O 。
③阴离子:N3-、O2-、F-、OH-、NH2-。
3.核外电子总数为18的粒子
①分子:SiH4、PH3、H2S、HCl、Ar、F2、H2O2、C2H6、
CH3OH、CH3F、N2H4等。
②阳离子:K 、Ca2 。
③阴离子:S2-、HS-、Cl-、O22-。
4.核外电子总数及质子数均相等的粒子:
①Na 、NH4 、H3O 。
②F-、OH-、NH2-。
③HS-、Cl-。
④N2、CO、C2H2。
⑤C6H6、B3N3H3。
方法点击
在学习电子数相同的粒子时,一定要利用元素周期表这一化学工具。
如:10电子粒子在元素周期表中以10电子的Ne原子向后推有:Na 、Mg2 、Al3 ;向前推有N3-、O2-、F-、OH-、NH2-、NH4 、H3O 、CH4、NH3、H2O、HF。
18电子的应以Ar向前后扩散,但不要忘记(9 9=18)
如:F2、H2O2、C2H6、CH3OH、CH3F、N2H4等。
形成一定的思维定式可以提高做题的速度,但有时要打破自己的这种思维定式。
例:甲、乙、丙、丁为前三周期元素形成的粒子,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是__________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:__________________。
(3)在一定条件下,甲与O2反应的化学方程式是____________________________________。
(4)丁的元素符号是_________,它的原子结构示意图为_________。
(5)丁的氧化物的晶体结构与_________的晶体结构相似。
我们看到此题中有等电子的粒子就想到10电子体、18电子体,但按10电子体、18电子体推不出正确结论,所以我们要打破这种思维定式,重新找突破口:丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,经排查知中学化学中常见的这种反应是:电石与水反应生成可燃性气体C2H2,这样此题就迎刃而解。丙为C22-有14个电子,甲、乙、丁也含14个电子,依题意得:甲为N2、乙为CO、丁为SiO2。
06
考点6 粒子半径大小比较
1.电子层数&半径
一般电子层数越多,其半径越大〔极少数例外,如r(Li)<r(Al)〕。此规律包含了如下两种情况:
(1)同主族元素,由上而下,原子半径逐渐增大,离子半径逐渐增大,如:r(K)>r(Na),r(K )>r(Na )。
(2)原子半径比相应的阳离子半径大,如:r(K)>r(K ),r(Mg)>r(Mg2 )。
2.核电荷数&半径
(1)同周期主族元素自左至右原子半径逐渐减小(0族例外),如:r(Na)>r(Mg)>r(Al)。
(2)电子层数相同的离子,核电荷数越大,半径越小,如:r(O2-)>r(F-)>r(Na )>r(Mg2 )。
3.最外层电子数&半径
若电子层数、核电荷数均相同,最外层电子数越多,半径越大。
(1)同一元素的原子和阴离子,原子半径比阴离子半径小,如:r(F)<r(F-)。
(2)同一元素价态不同的阳离子,核外电子数越多,半径越大,如r(Fe2 )>r(Fe3 )。
方法点击
粒子半径大小比较归纳为“同层比核,同核比层”。
“同层比核”如:Na 与F-,Cl与S,Cl-与S2-;电子层数相同,核电核数越大,核对电子的引力越大,半径越小;同理,“同核比层”,例:Na与Na 、Cl与Cl-的核电荷数相同,核外电子数越大,原子(或离子)半径越大。
在解答这类问题时,我们可以借助元素周期表进行解答。
07