化学是对物质的组成、结构、性质和变化的研究。
物质是任何具有静止质量和体积并由粒子组成的东西。化学主要关注原子及其与其他原子的相互作用。
1.原子和离子

原子是物质的基本单位,每个原子都由一个原子核和一个或多个与原子核结合的电子组成。原子核由一个或多个质子和一些中子组成。只有最常见的氢没有中子。
每一种固体、液体、气体和等离子体都是由中性或电离原子组成的。
- 原子核
原子质量的 99.9% 以上在原子核中。质子带正电,电子带负电,中子不带电。如果质子数和电子数相等,则原子呈电中性。如果一个原子的电子数多于或少于质子数,那么它的总电荷分别为负电荷或正电荷——这样的原子称为离子。
- 离子
离子是带有净电荷的原子或分子。
阳离子是带正电的离子,电子比质子少,而阴离子是带负电的离子,电子比质子多。相反的电荷被静电力拉向彼此,因此阳离子和阴离子相互吸引并容易形成离子化合物。
仅由一个原子组成的离子称为原子或单原子离子,而两个或多个原子形成分子离子或多原子离子。在流体(气体或液体)中发生物理电离的情况下,“离子对”是由自发的分子碰撞产生的,其中每个生成的离子对由一个自由电子和一个正离子组成。离子也是通过化学相互作用产生的,例如盐在液体中的溶解,或通过其他方式产生,例如使直流电通过导电溶液,通过电离溶解阳极。
2.分子

分子由两个或多个原子通过称为化学键的吸引力结合在一起。分子可以是同核分子,即它由一种化学元素的原子组成,例如氧分子 (O 2 ) 中的两个原子;或者它可以是异核的,一种由不止一种元素组成的化合物,例如水(两个氢原子和一个氧原子;H 2 O)。
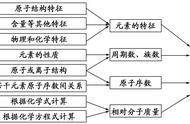
3.元素和元素周期表

- 化学元素
化学元素是在其原子核中具有给定数量的质子的原子种类,包括仅由该种类组成的纯物质。与化合物不同,化学元素不能通过任何化学反应分解成更简单的物质。原子核中的质子数是元素的定义属性,称为原子序数(用符号Z表示)——所有具有相同原子序数的原子都是同一元素的原子。
当不同的元素发生化学反应时,原子会重新排列成通过化学键结合在一起的新化合物。只有少数元素,如银和金,被发现是未结合的相对纯净的天然元素矿物。几乎所有其他天然存在的元素都以化合物或混合物的形式存在于地球上。空气主要是氮气、氧气和氩气的混合物,尽管它确实含有包括二氧化碳和水在内的化合物。
- 元素周期表

化学元素的性质通常使用周期表进行总结,该表通过将原子序数增加到行(“周期”)中来有力而优雅地组织元素,其中列(“组”)共享重复出现的(“周期性”)物理和化学性质。目前的标准表包含截至 2021 年已确认的 118 个元素。
元素周期表的第一个详细形式是由门捷列夫开发的(基于质量数),但后来亨利·格温·杰弗里的莫斯利根据原子序数制作了一个新的元素周期表。莫斯利被称为现代元素周期表之父。
元素周期表的使用在化学学科中无处不在,它提供了一个非常有用的框架来分类、系统化和比较所有许多不同形式的化学行为。该表还在物理学、地质学、生物学、材料科学、工程学、农业、医学、营养学、环境健康和天文学中得到广泛应用。它的原理在化学工程中尤为重要。