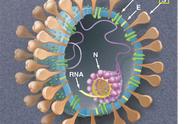
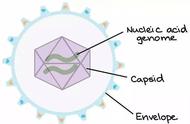
兽医将冠状病毒根据种类的不同,其基因组编码的结构蛋白有4一5种,分别突出蛋白 s(spikeprotein),核衣壳蛋白N(Nueleoe即 sidprotein),膜蛋白M(Membraneprotein),小膜蛋白 E(Smallmembraneprotein)及血凝素酷酶HE(Hemagglutinin一esterase)。血凝素酷酶HE主要存在第二群病毒,比如猪血凝性脑脊髓炎病毒、小鼠肝炎病毒、牛冠状病毒和人呼吸道冠状病毒OC43等囊膜表面。
1. S蛋白
S基因编码的S蛋白是伸出囊膜的棒一球形的糖蛋白,长度为20nm,S蛋白构成了病毒的长杆状包膜突起,突起突出在病毒粒子的表面。3个S蛋白通过非共价键连接构成突起,S蛋白是主要是促进病毒和宿主细胞表面受体介导的抗原蛋白和膜融合,是主要的结构蛋白,该蛋白还是诱发细胞免疫和体液免疫的重要组成成分。一般由1400一1800个氨基酸所组成,分子量大小约为180kDa,从N一末端到C一端有三个区域组成,分别突出的部分外囊及跨膜区的包衬或细胞质域,突出囊膜的外部分膜可分为s1和52,sl和52是在病毒成熟过程中经过糖基化后被蛋白酶切割成的,sl与52是通过非共价键连接的,51位于病毒体外部,是病毒突起的球形头部,主要是参与病毒与宿主细胞之间的识别与结合,52也位于病毒体外部,借助于跨膜区锚定在膜上,呈柄状,主要是促进病毒与宿主细胞的融合。
在不同的冠状病毒中,甚至是同一种病毒的不同毒株中,Sl的序列变异性相对较大,其氨基酸长度及序列都会出现多样性,这种差异可能是导致基因突变和*。在不同的冠状病毒中,s2序列则有约30%的同源性,s2上有脂酞化位点以及两个七氨基酸重复,形成卷曲的a螺旋结构。不同的冠状病毒S蛋白被酶切为的程度是不同,S蛋白是否被切成sl和52与病毒包膜与细胞膜融合活性是没有必然联系的,但是S蛋白被酶切成Sl和52能够促进病毒包膜与细胞膜或者细胞膜之间的融合,并能增强病毒的感染。有资料表明,S蛋白的酶切对于某些病毒来说是诱导膜融合活性所必要的。Sl和52仍以非共价键结合在一起,但是如果失去sl部分,病毒则会失去感染性。并不是所有的S蛋白都有酶切位点,有的S蛋白就不会被切割,但它仍然可以诱导细胞的融合。这表明在S蛋白构象的改变病毒感染中起着重要作用,对病毒的包膜的形成是必不可少的,在病毒的出芽以及胞外分泌过程也是必要的1371。成熟的S蛋白突起具有多种功能,其中就包括负责与宿主细胞受体结合,诱导病毒包膜与细胞膜及细胞膜之间的融合,与病毒的入侵感染密切相关。病毒主要通过S蛋白上的受体结合结构域与细胞受体特异性结合,受体结合结构域位于S1亚单位上,当受体结合结构域与细胞受体结合后,诱导S蛋白构象发生改变,暴露穿膜有效结构域,介导病毒包膜与细胞膜发生融合,使病毒核蛋白进入细胞胞质。其功能之二是携带B细胞抗原决定簇,诱导机体产生中和抗体,提供免疫保护,s蛋白携带的B细胞抗原决定簇是唯一能够诱导机体产生中和抗体的结构蛋白,S蛋白的主要抗原位点是位于该蛋白的前1/2的序列中。其功能之三是与病毒毒力的强弱密切相关,s蛋白某些位点的突变后对于病毒的毒力强弱有重要影响。其功能四是决定冠状病毒的血凝性,某些冠状病毒HEv、IBv、TGEv等具有血凝作用。

2. M蛋白
M蛋白横跨于病毒囊膜上,具有三个结构域,分别为包内膜的胞质域、跨膜域以及膜外的N亲水末端。M蛋白也是一种糖蛋白,是病毒包膜和宿主细胞表面最丰富的穿膜蛋白,长约221一262aa,分子量为20一3okD。M蛋白主要负责病毒颗粒的组装,M蛋白自身作用形成均一的复合体,、S、N、E等蛋白能与该蛋白相互作用形成不均一的复合体,单独的M蛋白是不能够诱导病毒粒子形成的,必须先于E蛋白作用被激活后才能被组装到病毒粒子内。M蛋白具有高度保守的糖基化序列,其糖链连接的方式主要有N一或O-的连接到膜蛋白上,第一、三群冠状病毒是以N一的方式连接到膜蛋白上的,第二群冠状病毒的连接方式是以0一的方式连接的。病毒和宿主之间的相互作用可能与M蛋白糖基化有关系,MHV中M蛋白如果O一糖基化位点被N一糖基化所取代以后,那么病毒样颗粒的组装效率明显的下降。M蛋白还与冠状病毒的免疫原性相关,此外还能诱导干扰素的产生脾。
3 N蛋白
N蛋白是一种核衣壳碱性磷酸化蛋白,长约377碑54aa,分子量为50一60切。在N末端存在有一高度保守的基因序列FYYLGTGP。N蛋白首先是与基因组RNA在胞浆中结合形成螺旋卷曲的核衣壳,并与M、E蛋白相互作用后包裹进入病毒衣壳内,S蛋白在病毒膜出芽成熟时插入,并与M蛋白相用后形成病毒体从囊泡中释放。N蛋白与病毒基因组RNA间存在两种互相识别作用,一是N蛋白只能和完整的病毒基因组RNA结合,这与病毒基因组RNA中包装信号序列(packaging signalsequence)有关;二是M蛋白与N蛋白与病毒RNA的结合物发生相互作用,这种识别与某些辅助因子有关。
4 E蛋白
E蛋白是一种小包膜蛋白,该蛋白在病毒颗粒中的含量是很少的,大小约为9一12kD,E蛋白中含有一个疏水结构域,带电荷的残基连接在其侧面,一个半胧氨酸区域位于其后面。E蛋白与病毒包膜的形成有关,与M蛋白共同表达,形成E一M蛋白复合体,产生病毒样粒子(VLPS),E、M蛋白可能是产生病毒最小的组装机制,如果E蛋白缺失,病毒样粒子的复制量大大减少,单独的E蛋白是不能够产生VLPs的,病毒的最终形态的形成与E蛋白是密切相关的。
E蛋白在病毒包膜及病毒颗粒的形成过程中具有关键作用,N端的疏水性氨基酸作为VLPs包膜开始形成的支点,一旦氨基酸发生突变,就会导致病毒颗粒变性,无法诱导病毒样粒子的形成;如果N末端跨膜区缺失,也会导致突变蛋白的随机分布以及功能缺失的病毒粒子的装配,此外E蛋白在病毒形态发生及组装过程中起着非常重要的作用。

5 HE蛋白
HE蛋白主要存在于第二群病毒,如HEV、HCoV.OC43、MHV一等,也见于第三群的火鸡冠状病毒中,是由二硫键连接的65一70kD蛋白质的二聚体,在病毒粒子上形成短突起。HE蛋白与C型流感病毒的血凝素蛋白有30%的相似氨基酸序列,推测可能来自C型流感病毒 HEmRNA与古老冠状病毒基因组RNA两者的*。
HE蛋白具有乙酞脂酶活性,能在9-O-乙酞化的神经氨酸上切割下乙酞基团,从而防止了或逆转了S或HE引起的凝血或血细胞吸附,说明HE可能涉及病毒进入感染细胞或病毒从感染细胞中的释放。有研究表明HE蛋白对病毒的复制不是很重要的,该蛋白在第二群病毒中是高度变化的以及在在连续培养病毒传代时频繁发生突变或完全缺失。HE蛋白可能介导病毒与细胞膜最初的吸附,随后需要S蛋白与特定受体的相互作用。HE蛋白在病毒感染中并不是绝对需要的,但是HE蛋白的存在却可以改变病毒在动物体内的致病性。
,