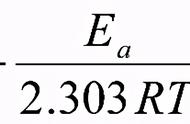不同的化学反应在相同条件下反应速率不同,说明化学反应速率首先由物质本身的性质(内因)决定。
在实际工业生产和化学实验中,需要加快某些化学反应的速率,如实验室用二氧化锰和浓盐酸制氯气,有时又需要减缓某些化学反应的速率,如食物的变质、塑料和橡胶的老化、金属的腐蚀等。要控制化学反应的速率,则需要了解化学反应速率的影响因素(外因)。
实验:影响化学反应速率的外界因素
实验原理:影响化学反应速率的因素有多种,包括反应温度、反应物的浓度、催化剂等。对于多因素(多变量)的问题,为了得到准确的结论,在实验中常常采用“控制变量法”,遵守单一变量的原则,即在每次实验时只改变其中某一个因素(变量),控制其它因素(变量)不变。比如,研究温度对化学反应速率的影响,就控制其它条件相同,只改变温度;研究反应物浓度对化学反应速率的影响,就控制其它条件相同,只改变反应物的浓度。

下面以H2O2的分解来探究温度、催化剂对化学反应速率的影响。以石灰石与盐酸反应探究浓度对化学反应速率的影响。

实验内容:
(1)反应温度对化学反应速率的影响
操作:取两支试管,各加入2mL5%的H2O2溶液,各滴入2滴0.1mol/L的FeCl3溶液。一支放入5℃的冷水浴中,一支放入40℃的热水浴中。观察现象。

现象:两支试管中均产生气泡,冷水浴中产生气泡较慢,热水浴中产生气泡较快。
结论:温度越高,H2O2的分解速率越快;温度越低,H2O2的分解速率越慢。
(2)反应物的浓度对化学反应速率的影响
操作:向两支试管中各加入少量的大理石碎块,再分别加入0.1mol/L和1mol/L的稀盐酸。观察现象。