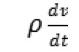催化剂在中学化学中经常出现,而且种类较多,涉及的化学反应也很多,很多同学在解决有关催化剂问题时往往表现出概念不清,分类不清,使用混淆等诸多问题。因此,有必要对催化剂的知识做一个较为全面的探讨。
一、催化剂的概念
所谓催化剂指的是在化学反应中能改变其它化学反应的速率(提高或降低),而自身的质量和化学性质在反应前后不变的物质。
催化剂所起的作用称为催化作用。固体催化剂在工业上也称为触媒。
催化剂从催化作用上可分为正催化剂和负催化剂。
正催化剂能加快化学反应速率,负催化剂能减慢化学反应速率。
负催化剂的研究意义远不及正催化剂,因此,如没有特别说明,一般都指的是正催化剂。
例如,酯和多糖的水解,常用无机酸作正催化剂;二氧化硫氧化为三氧化硫,常用五氧化二钒作正催化剂;食用油脂里加入0.01%-0.02%没食子酸正丙酯,就可以有效地防止酸败,在这里,没食子酸正丙酯是一种负催化剂(也叫做抑制剂)。
二、催化剂的发现
催化剂最早由瑞典化学家贝采里乌斯发现。
100多年前的一天,瑞典化学家贝采里乌斯在化学实验室忙碌地进行着实验,傍晚,他的妻子玛利亚准备了酒菜宴请亲友,祝贺他的生日。贝采里乌斯沉浸在实验中,把这件事全忘了,直到玛丽亚把他从实验室拉出来,他才恍然大悟,匆忙地赶回家。一进屋,客人们纷纷举杯向他祝贺,他顾不上洗手就接过一杯蜜桃酒一饮而尽。当他自己斟满第二杯酒干杯时,却皱起眉头喊道:“玛利亚,你怎么把醋拿给我喝!”玛利亚和客人都愣住了。玛丽亚仔细瞧着那瓶子,还倒出一杯来品尝,一点儿都没错,确实是香醇的蜜桃酒啊!贝采里乌斯随手把自己倒的那杯酒递过去,玛丽亚喝了一口,几乎全吐了出来,也说:“甜酒怎么一下子变成醋酸啦?”
客人们纷纷凑近来,观察着,猜测着这“神杯”发生的怪事。
贝采里乌斯发现,原来酒杯里有少量黑色粉末。他瞧瞧自己的手,发现手上沾满了在实验室研磨白金时给沾上的铂黑。他兴奋地把那杯酸酒一饮而尽。原来,把酒变成醋酸的魔力是来源于白金粉末,是它加快了乙醇(酒精)和空气中的氧气发生化学反应,生成了醋酸。
1836年,他首次提出“催化”与“催化剂”概念。

三、催化剂的主要分类
催化剂种类繁多,按状态可分为液体催化剂和固体催化剂;
按反应体系的相态分为均相催化剂和多相催化剂;
按照反应类型又分为聚合、缩聚、酯化、缩醛化、加氢、脱氢、氧化、还原、烷基化、异构化等催化剂;
按照作用大小还分为主催化剂和助催化剂。
⒈ 均相催化
催化剂与反应物均处于同一相中的催化作用,没有相界存在而进行的反应,称为均相催化作用,能起均相催化作用的催化剂为均相催化剂。如均相酸碱催化、均相络合催化、可溶性过渡金属化合物和过氧化物催化。均相催化大多在液相中进行。均相催化剂以分子或离子独立起作用,活性中心均一,具有高活性和高选择性,副反应较少,但催化剂难以分离、回收和再生。
⒉ 多相催化
多相催化剂又称非均相催化剂,发生在两相界面上的催化作用。多相催化剂有固体酸催化剂、有机碱催化剂、金属催化剂、金属氧化物催化剂、络合物催化剂、稀土催化剂、分子筛催化剂、生物催化剂、纳米催化剂等;通常催化剂为多孔固体,反应物为液体或气体。固体催化剂表面是不均匀的,只有部分点对反应物分子发生化学吸附,称为活性中心。工业生产中的催化作用大多属于多相催化。
例如:在生产人造黄油时,通过固态镍(是一种多相催化剂),能够把不饱和的植物油和氢气转变成饱和的脂肪。
⒊ 生物催化
生物体内在酶作用下进行的催化反应。其主要特点有三个:反应条件温和,具有高度专一性,具有高效催化活性。但受温度、溶液中的pH值、离子强度等因素影响较大。
酶作为催化剂主要在动物体内新陈代谢中起作用,活的生物体利用它们来加速体内的化学反应。如果没有酶,生物体内的许多化学反应就会进行得很慢,难以维持生命。
例如:酶催化淀粉水解为糊精和麦芽糖,蛋白酶催化蛋白质水解成肽等。
大约在37℃的温度中(人体的温度),酶的工作状态是最佳的。如果温度高于50℃或60℃,酶就会被破坏掉而不能再发生作用。因此,利用酶来分解衣物上的污渍的生物洗涤剂,在低温下使用最有效。
酶在生理学、医学、农业、工业等方面,都有重大意义。当前,酶制剂的应用日益广泛,某些酶还是珍贵的药物。
⒋ 自动催化
反应产物的自我催化作用。在一些反应中,某些反应的产物或中间体具有催化功能,使反应经过一段诱导期后速率大大加快。自催化作用是发生化学振荡的必要条件之一。
⒌ 其他
还有电催化、光助催化、光电催化等.....

四、催化剂的催化原理
当前,对催化剂的作用还没有完全弄清楚。在大多数情况下,人们认为催化剂本身和反应物一起参加了化学反应,降低了反应所需要的活化能。这样就会使更多的反应物分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数,从而成千成万倍地增大化学反应速率。
⒈ 吸附作用理论 在多相催化反应中,固体催化剂对反应物分子发生化学吸附作用,使反应物分子得到活化,降低了反应的活化能,而使反应速率加快。吸附作用仅能在催化剂表面最活泼的区域(叫做活性中心)进行。活性中心的区域越大或越多,催化剂的活性就越强。
其催化反应按照下列步骤进行:
扩散—反应物扩散到催化剂的表面;
吸附—反应物被吸附到催化剂表面;
反应—被吸附的反应物在催化剂表面解离各键,并因此发生反应,生成新产物;
脱附—新的产物从催化剂表面解吸;
扩散—产物从催化剂表面扩散。
⒉ 中间产物理论 在均相催化反应中,由于催化剂与反应物形成了很容易分解的“中间产物”,使反应机理转变为另一个拥用较低活化能的新机理,故反应速率得以提升。分解时催化剂恢复了原来的化学组成,原反应物就变成了生成物。催化剂只是作为一个反应中介,本身在反应中不会被消耗,不管是反应前还是反应后,它们都能够从反应物中分离出来。不过,它们有可能会在反应的某一个阶段中被消耗,然后在整个反应结束之前又重新产生。
其催化原理为:
A C→AC
AC B→AB C
这两步的活化能都比E值小得多。根据阿伦尼乌斯公式k=Ae-E/RT,由于催化剂参与反应使E值减小,从而使反应速率显著提高。
也有某些反应,催化剂参与反应后,活化能E值改变不大,但指前因子A值明显增大(或解释为活化熵增大),也导致反应速率加快。