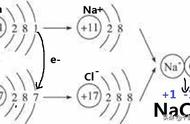
- 汞在空气中稳定,微溶于水,在有空气存在时溶解度增大,溶于硝酸和热浓硫酸,能和稀盐酸作用在其表面产生氯化亚汞膜,但与稀硫酸、盐酸、碱都不起作用。能溶解许多金属包括(金和银,但不包括铁),形成合金,合金叫做汞齐。汞具有强烈的亲硫性和亲铜性,即在常态下,很容易与硫和铜的单质化合并生成稳定化合物,因此在实验室通常会用硫单质去处理撒漏的水银。一般汞化合物的化合价是 1或 2, 4价的汞化合物只有四氟化汞,而 3价的汞化合物不存在。其金属活跃性低于锌和镉,且不能从酸溶液中置换出氢。二价汞的含氧酸盐都是离子化合物,在溶液中完全电离,但其硫化物和卤化物都是共价化合物,与水、空气、稀的酸碱都不起作用。
【汞的化合物】
- 汞的无机化合物

- 汞的无机化合物如硝酸汞(Hg(NO3)2)、升汞(HgCl2)、甘汞(HgCl)、溴化汞(HgBr2)、砷酸汞(HgAsO4)、硫化汞(HgS)、硫酸汞(HgSO4)、氧化汞(HgO)、氰化汞(Hg(CN)2)等,用于汞化合物的合成,或作为催化剂、颜料、涂料等;有的还作为药物,口服、过量吸入其粉尘及皮肤涂布时均可引起中毒。此外,雷汞Hg(CNO)2用于制造雷管等。
- 有机汞化合物
- 分子中含有碳-汞键的有机化合物称为有机汞化合物。有机汞化合物包括二烃基汞R2Hg[如(CH3)2Hg和(C6H5)2Hg等]及卤化烃基汞RHgX等,有机汞在有机合成中有一定的用途,例如烯烃羟汞化-脱汞反应的中间物就是有机汞化合物;有机汞化合物也用于医药(如红汞)。有机汞化合物的毒性较无机汞(氯化汞口服中毒量为0.5g,致死量1-2g)为大。人经口误服氯化乙基汞在3mg/kg.bw左右即重度中毒。
【汞的同位素】
- 汞共有7个稳定的同位素,具体信息如下表所示: