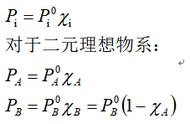(公式13) (2)由ΔrHmθ和ΔrSmθ计算ΔrGmθ ΔrGmθ=ΔrHmθ-TΔrSmθ(公式14) (3)利用状态函数特性计算

四、化学反应平衡 1、标准平衡常数 化学平衡的特征 定υ正= υ逆,各物质的量不再随时间而改变;ΔrGm = 0,化学平衡是可逆反应的最终状态。 动υ正= υ逆,并非反应停止进行,只是正逆反应的影响相互抵消,是一种动态平衡。 变 化学平衡是有条件的、相对的和暂时的。 标准平衡常数

(公式15) p(B)为化学反应中气态物质B的分压,p(B)/pθ称为B相对压力; 方次为化学反应方程式中各物质前面的系数。 标准平衡常数的意义:Kθ越大,表示正反应进行的越完全;影响Kθ的因素:系统的温度,反应的本性; Kθq一定与化学反应方程式匹配。Kθ与方程式相对应纯固体、纯液体和稀溶液的溶剂,其浓度视为常数,不写进Kθq表达式中。多重平衡规则:在多重平衡中,一个反应可以表示为 两个或更多个反应之和(或差),则总反应的Kqθ等于各步反应的平衡常数的积(或商)。 Kqθ值与温度有关,书写Kθq 的表达式应注明温度。 2、化学反应等温式

等温等压下不做非体积功的化学反应