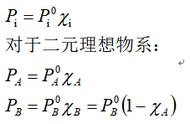公式29 Kspθ大小反应了难溶强电解质的溶解能力。是温度的函数 溶解度与溶度积的关系 相同类型的难溶电解质Kspθ大,溶解度s大 2、沉淀的生成和溶解 (1)溶度积规则

q(2)沉淀的生成 同离子效应:在难溶强电解质的多相离子平衡系统中,加入具有相同离子的易溶电解质,会使难溶电解质的溶解度下降的现象。 分步沉淀:混合溶液中离子发生先后沉淀的现象。 沉淀的顺序:所需沉淀剂浓度小的离子先沉淀。 沉淀完全的条件:离子浓度<10-5 mol·L-1 (3)沉淀的转化 沉淀转化的方向:向更难溶电解质的方向转化。两种沉淀物的溶度积差别越大,沉淀转化越完全 一、氧化还原反应 1、基本概念 ·还原剂:失去电子(氧化数升高)的物质,发生氧化反应。 ·氧化剂:得到电子(氧化数降低)的物质,发生还原反应。 ·氧化还原反应由氧化半反应和还原半反应构成,每个半反应均表示同种元素两种价态间的转化 ·氧化还原电对: 表示符号:氧化型/还原型 共轭关系:氧化剂氧化能力越强,还原剂还原能力越弱。 ·氧化还原反应进行的方向 强氧化剂 强还原剂→ 弱还原剂 弱氧化剂 2、离子—电子法配平氧化还原反应方程式 ·将反应分成氧化和还原两个未配平的半反应 ·配平半反应:原子个数相等,电荷数相等--添加电子 ·合并半反应:得失电子总数相等。 ·核对 配平半反应式: 酸性介质中,多氧一边加H ;在缺氧一边加H2O 碱性介质中,多氧一边加H2O;在缺氧一边加OH- 酸性介质中的反应不可出现OH-;碱性介质中的反应不可出现H 二、原电池和电动势 1、原电池 (1)电池反应、电极反应 电极反应:原电池反应在电极表面进行,半电池反应又叫电极反应。 电池反应:两个半电池反应之和。 电极的种类 金属电极、非金属电极、氧化还原电极。电极构成要素:氧化还原电对、导电体 (2)原电池图示 用“¦¦”表示盐桥,负极在左,发生氧化反应;正极在右,发生还原反应正负极中电解质溶液紧靠盐桥写,用“│”表示界面,注明组成电极的物质的状态、组成、正负极 (-) Zn│Zn2 (c1)‖Cu2 (c2)│Cu( ) (3)可逆电池 可逆电池必须满足的条件 A.电极反应和电池反应必须可以正、逆两个方向进行,且互为可逆反应; B.通过电池的电流必须无限小,电极反应是在接近电化学平衡的条件下进行的。 (4)可逆电池热力学 ΔrGmθ=-nFEθ(公式30) Eθ原电池标准电动势 Eθ=

-

- n:电池反应中转移的电子数 F:法拉第常数 96485C·mol-1 三、电极电势 1、标准电极电势 (1)标准氢电极Pt∣H2(100kPa)∣H (1.0mol·L-1)