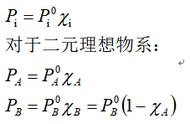(公式26)

(公式27) (3)多元弱酸弱碱溶液pH的计算 从解离常数看:Ka1q >> Ka2q H2S溶液中的离子浓度相对大小:c (H2S) >> c (H ) ≈ c (HS-) >> c (S2-) 多元弱酸中,负二价离子的浓度近似等于二级解离常数 (4)离子酸、离子碱的解离平衡 离子酸、离子碱的解离常数随温度升高而增大 Kaθ·Kbθ=kw 2、同离子效应与缓冲溶液 (1)同离子效应:在弱电解质溶液中加入与弱电解质具有相同离子的强电解质而使弱电解质的电离度下降的现象。 (2)缓冲溶液 在一定范围内,能抵抗少量外加酸、碱或稀释而保持溶液的pH值基本不变的溶液 组成:弱酸-共轭碱;弱碱-共轭酸。 缓冲对 缓冲溶液pH值的计算

(公式28)

缓冲溶液中加入少量强酸、强碱、少量水时,缓冲溶液的pH值基本不变。 缓冲溶液的缓冲能力是有限度(缓冲容量)的。 所选缓冲对的pKa值(或pKb值)尽可能的接近要配溶液的pH值(或pOH值) 如果配制pH≤2或pH≥12的缓冲溶液,直接选取强酸或强碱溶液按要求的pH值配制成相应的浓度即可。 如果配pH在2~12之间的缓冲溶液,应尽可能选用pH=pKa的弱酸及其共轭碱配制。 四、沉淀溶解平衡 1、标准溶度积Kspθ