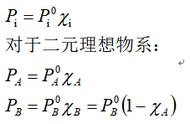(公式20)当温度由T1 升高到T2,活化能大的反应,反应速率常数增加的倍数大。 活化能对反应速率的影响 当温度一定,不同的反应:活化能越小反应速率越快。 活化能大的反应:温度对反应速率常数的影响越大。 发生有效碰撞条件①反应物分子具有足够高的能量。②反应物分子碰撞时的取向要适当。 反应的活化能越大,反应的阻力越大,反应就越难进行。 ΔrHm≈ΔrUm=Ea正-Ea逆>0 该正反应为放热反应 加快反应速率的方法 (1)增大反应物浓度。(2)升高温度。(3)降低活化能。 5、催化剂对反应速率的影响 催化剂作用关键:大大降低了反应的活化能 性质: 催化剂能同时加快正、逆反应速率。 催化剂不能改变反应的方向和限度。 催化剂只能对热力学上可能发生的反应起加速作用。 溶液 1、溶液组成的表示方法 物质B的质量摩尔浓度bB或mB 定义:溶质B的物质的量(以mol为单位)除以溶剂的质 量(以kg为单位)。

2、稀溶液的拉乌尔定律 拉乌尔定律:一定温度下,稀溶液中溶剂的蒸气压pA等于同一温度下纯溶剂的饱和蒸气压pA*与溶剂的摩尔分数xA的乘积。 溶液中溶剂的蒸气压下降值与溶液中溶质的摩尔分数成正比,与溶质的种类无关。 pA=pA*xA(公式21) 3、稀溶液的依数性 (1)稀溶液的蒸汽压下降 ΔP=KbB K 与溶剂的本性有关,溶剂一定,其值一定。 溶液中溶剂蒸汽压下降值与溶液中溶质的质量摩尔浓度成正比,与溶质的种类无关。 (2)稀溶液的沸点上升 ΔTb= KbbB (公式22) (3)稀溶液的凝固点下降ΔTf=KfbB (公式23) (4)稀溶液的渗透压 ΠV = nRT(公式24) 溶液渗透压只与溶液中溶质的浓度有关,与溶质的本性无关 二、酸碱质子理论 1、酸碱的定义与共轭关系 酸:凡是能给出质子的物质(分子或离子)都是酸。 碱:凡是能够接受质子的物质(分子或离子)都是碱。 共轭酸

质子 共轭碱 Ø Ø ①酸越强,共轭碱碱性就越弱。②质子酸碱两性物质。③酸碱质子理论排除盐的概念,离子酸、离子碱。 2、酸碱反应 1)酸碱反应的实质:两个共轭酸碱对之间的质子传递过程。 2)酸碱反应的方向:总是向着生成较弱的酸和较弱的碱的方向。 三、水溶液中的酸碱平衡 1、弱酸弱碱的电离平衡 (1)标准解离平衡常数Kθ Kq是温度的函数,与电解质的起始浓度无关。我们不考虑温度对弱酸弱碱解离常数的影响。 弱酸的Kaθ越大,表示给出质子能力越强,酸越强。 弱碱的Kbθ越大,表示接受质子能力越强,碱越强。 (2)一元弱酸弱碱溶液pH计算 一元弱酸C(H )=

(公式25) 一元弱碱C(OH-)=