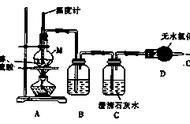
28离子键及离子化合物知识点
1.化学键
(1)概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
(2)类型:离子键和共价键是两种常见的化学键。
2.离子键
(1)形成过程(以NaCl的形成为例) Na原子和Cl原子最外层电子数分别为1和7,均不稳定。
即它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质NaCl。
(2)概念:是使带相反电荷的阴阳离子结合的相互作用。
(3)构成粒子:阴离子和阳离子。
(4)离子键的实质是静电作用。这种静电作用不只是静电引力,而是指阴、阳离子之间的静电引力与电子之间、原子核之间斥力处于平衡时的总效应。

3.离子化合物
(1)概念:离子化合物是阴、阳离子通过离子键形成的化合物。
(2)常见类型
活泼金属氧化物:Na2O、MgO、Al2O3等;
绝大多数盐:NaCl、K2SO4、CaCO3等;
强碱:NaOH、Ba(OH)2、KOH、Ca(OH)2等。
其他:活泼金属氢化物,如LiH、NaH、CaH2等;
活泼金属过氧化物,如Na2O2等。
原子、离子及离子化合物的表示方法
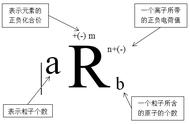
1.电子式的概念
在元素符号周围用"·"或"×"来表示原子的最外层电子,以简明地表示原子、离子的最外层的电子排布,这种式子称为电子式。
2.原子的电子式
将原子的最外层电子用小黑点"·"或小叉"×"来表示,并写在元素符号周围,如硫原子

碳原子
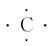
3.离子的电子式
(1)简单阴离子:既写出最外层所有电子数(包括得到的电子),又要用方括号"[ ]"括起来,并在右上角注明负电荷数。如氯离子